ABSTRACT
Objective: Asthma and respiratory symptoms are common in children, and many studies have shown associations between childhood
symptoms and impaired lung function in adult life. The aim of the present study was to investigate the association of various respiratory
symptoms with wheezing patterns (persistent, early, and late-onset) and lung function, as well as to determine whether lung function was
associated with atopy or with demographic, socioeconomic, environmental, and gestational factors, in a birth cohort at 6-7 years of age.
Methods: The target population consisted of children aged 6-7 years from a birth cohort of 5,304 children born in southern Brazil in 1993.
For this follow-up evaluation, 532 of those children were randomly selected, and a sub-sample was submitted to spirometry and skin prick
tests. A questionnaire was administered to the parent(s) or legal guardian(s) of each child. Results: Spirometric values were lower in the
children with respiratory symptoms or asthma. Mean forced expiratory volume in one second/forced vital capacity ratio (FEV1/FVC ratio)
was lower in children with any of the following: current wheezing and asthma; asthma ever; four or more episodes of wheezing within the
preceding 12 months; sleep disturbance due to wheezing; and exercise-induced wheezing. Persistent wheezing was associated with lower
FEV1/FVC ratio. After multiple linear regression, exercise-induced wheezing was also associated with reduced FEV1/FVC ratio. Nonwhite skin
color and wheezing severe enough to limit speech were associated with lower FEV1. Conclusions: Children with persistent wheezing and
symptoms of severe asthma have impaired lung function at 6-7 years of age.
Keywords:
Asthma; Respiratory function tests; Respiratory sounds; Signs and symptoms, respiratory.
RESUMO
Objetivo: Asma e sintomas respiratórios são comuns na infância, e vários estudos têm demonstrado sua associação com função pulmonar
prejudicada na vida adulta. O objetivo deste estudo foi investigar a associação de diversos sintomas respiratórios com padrões de sibilância
(persistente, precoce e de início tardio) e função pulmonar aos 6-7 anos de idade em uma coorte de nascimentos, além de determinar se a
função pulmonar estava associada à atopia ou a fatores demográficos, socioeconômicos, ambientais e gestacionais. Métodos: A populaçãoalvo
compreendeu crianças de 6 a 7 anos de idade pertencentes à coorte de 5.304 nascimentos ocorridos em 1993 em Pelotas, no Sul do
Brasil. Para esse acompanhamento selecionaram-se aleatoriamente 532 dessas crianças, e uma subamostra foi submetida a espirometria
e testes cutâneos de puntura. Aplicou-se um questionário aos pais das crianças ou seus responsáveis. Resultados: Observamos valores
espirométricos mais baixos nas crianças com sintomas respiratórios e asma. A média da relação volume expiratório forçado no primeiro
segundo/capacidade
vital forçada (relação VEF1/CVF) foi menor nas crianças com sibilância atual e asma, asma alguma vez na vida, quatro
ou mais episódios de sibilância nos últimos 12 meses, sono perturbado pela sibilância e sibilância após exercícios. Sibilância persistente
foi associada a redução da relação VEF1/CVF. Após regressão linear múltipla, sibilância após exercícios também foi associada a redução da
relação VEF1/CVF. Cor da pele não-branca e fala prejudicada pela sibilância foram associadas a redução do VEF1. Conclusões: Crianças com
sibilância persistente e sintomas de asma grave apresentaram função pulmonar prejudicada aos 6-7 anos de idade.
Palavras-chave:
Asma; Testes de função respiratória; Sons respiratórios; Sinais e sintomas respiratórios
IntroduçãoA prevalência de asma na infância está crescendo em todo o mundo, e estudos sugerem que a mesma persista na vida adulta em 26% a 78% dos pacientes.(1-3)
No Brasil, há poucos estudos de base populacional sobre asma na infância. Nas cidades brasileiras envolvidas no estudo denominado International Study of Asthma and Allergy in Childhood (ISAAC), a prevalência cumulativa de diagnóstico médico de asma em crianças de 6 a 7 anos de idade variou de 4,5% a 20,4%.(4,5) Utilizando a mesma metodologia, outros autores encontraram uma prevalência de asma de 27% entre adolescentes de 13 a 14 anos de idade em uma outra cidade brasileira.(6)
Em um estudo realizado no Sul do Brasil, verificou-se que a prevalência de atendimentos de emergência por asma é alta (31%) entre pré-escolares e que a gravidade da asma é um dos preditores desses atendimentos.(7)
Asma e sintomas respiratórios são muito comuns na infância, e vários estudos têm demonstrado sua associação com função pulmonar prejudicada na vida adulta. Além disso, alguns autores demonstraram que função pulmonar prejudicada na infância é um fator de risco para função pulmonar anormal na vida adulta, concluindo que o prognóstico da asma ou dos sintomas respiratórios na infância é desfavorável.(8,9) Dois estudos longitudinais realizados na Austrália também demonstraram que função pulmonar prejudicada na infância pode estar associada a persistência da asma na vida adulta.(3,10)
A avaliação adequada da função pulmonar e o tratamento da asma na infância são importantes para a prevenção secundária de redução da função pulmonar e de doença pulmonar crônica na vida adulta.(8,9)
Poucos estudos realizados em países em desenvolvimento têm investigado a função pulmonar em crianças com sintomas de asma, e pouco se sabe sobre os fatores de risco para asma nesses países.
No presente estudo, tentamos determinar se diversos sintomas respiratórios estavam associados à função pulmonar aos 6-7 anos de idade em uma coorte de nascimentos, e também se a função pulmonar estava associada à atopia ou a fatores demográficos, socioeconômicos, ambientais e gestacionais.
MétodosEste estudo foi realizado em Pelotas, cidade de 300.000 habitantes no Sul do Brasil. A população-alvo compreendeu crianças de 6 a 7 anos pertencentes a uma coorte de 5.304 nascimentos ocorridos em 1993. Para esse seguimento, selecionamos 523 crianças, o que corresponde a uma amostra sistemática de 10% da coorte inicial de nascimentos, mais todas as crianças com baixo peso ao nascer. Essas crianças foram examinadas ao nascer e aos 6 meses, 12 meses e 4 anos de idade, conforme já descrito.(7) Um questionário foi aplicado aos pais de cada criança ou seus responsáveis. A avaliação incluiu um questionário, espirometria e um teste cutâneo de puntura. O estudo teve um poder estatístico de 80% (alfa = 5%) para a detecção de um risco relativo de 2 para exposições afetando 7,5% ou mais das crianças.
Das 494 crianças que completaram o questionário (93% da amostra inicial), 148 (30%) foram selecionadas aleatoriamente e convidadas a se submeter à espirometria e teste cutâneo de puntura. Esses testes foram realizados em 143 (96,6%) das 148 crianças.
Entrevistadores treinados aplicaram questionários às mães das 494 crianças entre junho e setembro de 2000. As perguntas sobre sintomas da asma foram baseadas no questionário do ISAAC.(11) Coletaram-se dados sobre a prevalência cumulativa de sibilância (sibilância alguma vez na vida) e sibilância nos últimos 12 meses (sibilância atual), bem como de tosse noturna, sibilância após exercícios, sono perturbado pela sibilância, fala prejudicada pela sibilância e diagnóstico médico de asma (asma alguma vez na vida e asma atual).
As características biológicas estudadas foram sexo e cor da pele (relatados pela mãe). Os fatores sócio-econômicos avaliados foram escolaridade materna (anos de estudo) e renda familiar (em salários mínimos: R$130 = US$75). Os fatores gestacionais estudados incluíram idade gestacional, tabagismo materno durante a gestação e baixo peso ao nascer. Bronquiolite no primeiro ano de vida e tabagismo em casa também foram investigados. Os dados relacionados aos fatores gestacionais foram coletados no momento do nascimento (em 1993). Os dados relacionados às outras variáveis foram coletados nos acompanhamentos de 1998 e 2000.
As variáveis relacionadas aos padrões de sibilância, conforme descrito por outros autores,(12) incluíram sibilância transitória (sibilância dos 6 meses aos 4 anos de idade e não aos 6 anos de idade), sibilância persistente (sibilância dos 6 meses até os 6 anos de idade) e sibilância de início tardio (sibilância somente aos 6 anos de idade), e foram avaliadas após um, quatro e seis anos de seguimento.
A espirometria basal foi realizada no Laboratório de Função Pulmonar do Hospital Universitário da Universidade Federal de Pelotas, e todos os testes espirométricos foram realizados por um assistente treinado. O volume expiratório forçado no primeiro segundo (VEF1), a capacidade vital forçada (CVF) e a relação VEF1/CVF, bem como o fluxo expiratório forçado a 25%, 50%, 75% e entre 25 e 75% da CVF (FEF25%, FEF50%, FEF75% e FEF25-75%, respectivamente), foram medidos utilizando-se um espirômetro do tipo pneumotacógrafo (Master Scope; Jaeger, Würtzburg, Alemanha), preenchendo, assim, os critérios da American Thoracic Society (ATS).(13)
Todas as manobras expiratórias forçadas foram realizadas com as crianças sentadas e usando um clipe nasal e um bocal. Todas a medições foram feitas de acordo com as diretrizes da ATS. Os melhores valores de VEF1 e CVF foram selecionados entre os obtidos em todas as manobras aceitáveis, enquanto os valores de FEF25-75%, FEF25% e FEF75% registrados foram os obtidos nas manobras com a soma mais alta de CVF e VEF1. Cinco crianças não foram submetidas a espirometria: 3 por terem utilizado medicamentos para asma recentemente ou por terem tido infecções do trato respiratório inferior recentemente, e 2 por terem se recusado a participar.
Os sujeitos realizaram de três a cinco manobras com uma variação de menos de 5% entre as medidas e um tempo expiratório de pelo menos 4 s. A calibração do equipamento foi realizada diariamente.
Para os propósitos do presente estudo, consideramos basicamente o VEF1 e a CVF, que são as variáveis espirométricas mais reprodutíveis, bem como a relação entre os dois. Entretanto, também realizamos uma análise exploratória utilizando os fluxos instantâneos FEF25%, FEF75% e FEF25-75%.
Os testes cutâneos de puntura foram realizados no antebraço interno utilizando-se diluições padrão de alérgenos em glicerol 50%. Os alérgenos utilizados foram ácaros, fungos, grama e poeira. A histamina foi utilizada como um controle positivo, e um controle negativo também foi incluído.
As reações foram analisadas após 15 min e consideradas positivas quando o diâmetro de induração foi ≥ 3 mm. A diferença entre as protuberâncias do alérgeno e do controle negativo deve exceder 3 mm. Os sujeitos foram considerados atópicos se apresentassem pelo menos um teste cutâneo de puntura positivo.
As variáveis de função pulmonar foram expressas em percentual do previsto, utilizando-se os valores de referência de Hsu,(12) e definidas como desfechos para as análises transversais realizadas aos 6-7 anos de idade. Os valores de referência ajustados para idade, sexo e altura foram derivados dos critérios da ATS. Médias e desvios padrão foram utilizados na análise descritiva. A regressão linear foi utilizada para avaliar a associação entre os desfechos e as variáveis independentes. O efeito conjunto das variáveis independentes sobre os desfechos foi analisado por regressão linear múltipla utilizando-se a opção robust do programa estatístico STATA (Stata Corp., College Station, TX, EUA). Cada variável de função pulmonar foi analisada em um modelo separado ajustado para todos os sintomas respiratórios, bem como para variáveis sociais, biológicas e ambientais. Todas as análises foram ajustadas para sexo e cor da pele. O nível de significância adotado para a exclusão ou a manutenção de qualquer variável no modelo foi de 0,05. As análises estatísticas foram ponderadas para compensar a superamostragem de sujeitos com baixo peso ao nascer. A assimetria (skewness) das variáveis foi verificada, e não foram necessárias transformações no VEF1, CVF, relação VEF1/CVF, FEF25%, FEF50% e FEF75%. Os dados referentes ao FEF25%-75% não tiveram distribuição normal e mostraram grande variabilidade, com desvios padrão elevados; portanto, esses dados foram excluídos das análises mesmo após transformação.
O teste do qui-quadrado de Pearson e o teste do qui-quadrado para tendências lineares foram utilizados para testar a associação entre as variáveis de exposição e os padrões de sibilância. O efeito conjunto das variáveis independentes sobre os desfechos foi analisado utilizando-se a regressão de Poisson. Dadas a natureza binária e a alta prevalência do desfecho, utilizamos a regressão de Poisson com a opção robust (programa STATA), uma vez que a utilização da regressão logística pode resultar em superestimação das taxas de prevalência.
O desenho do estudo foi aprovado pelo Comitê de Ética em Pesquisa da Faculdade de Medicina da Universidade Federal de Pelotas, bem como pelo Conselho Federal de Medicina. Todas as mães assinaram o termo de consentimento livre e esclarecido, e garantiu-se o anonimato.
ResultadosA amostra final incluiu 494 crianças, representado 92,5% da amostra proposta. A principal razão para perda do acompanhamento foi a mudança de endereço.
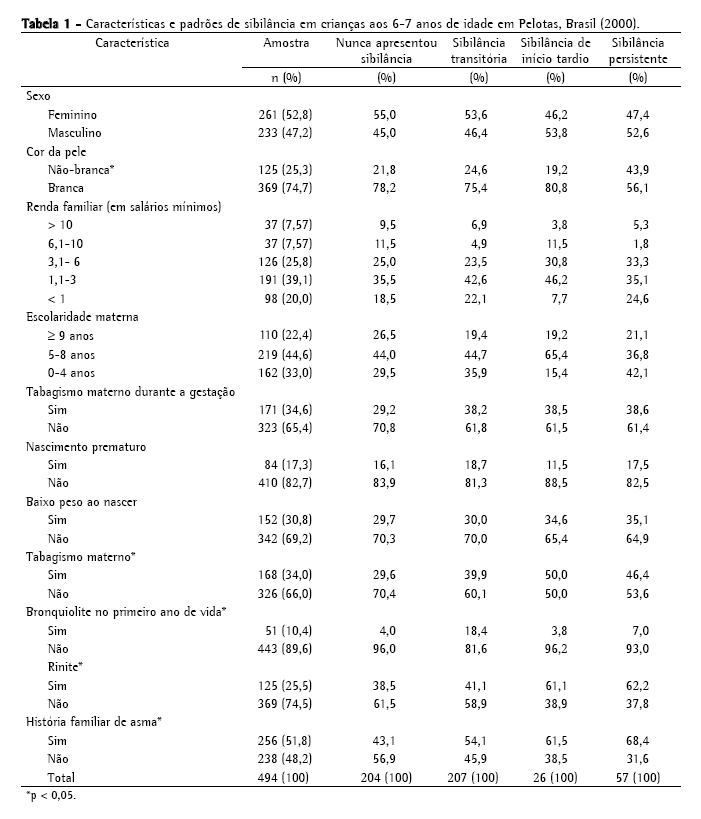
A maioria das crianças era branca (74,7%), do sexo feminino (52,8%) e de famílias de baixa renda (59% das famílias ganhavam ≤ 3 salários mínimos). Mais de 30% das crianças tinham estado em contado com tabagismo antes do nascimento ou em casa durante a infância (tabagismo materno), um quarto tinha história de rinite além de resfriados, e 46% apresentaram testes cutâneos positivos para atopia. As características demográficas, as variáveis sócio-econômicas e os padrões de sibilância são apresentados na Tabela 1.
Das 494 crianças que participaram deste estudo, 290 (58,7%) tinham apresentado sibilância até os 6 anos de idade. A prevalência de sibilância transitória, sibilância persistente e sibilância de início tardio foi de 42,0%, 11,6% e 5,3%, respectivamente. Rinite, história familiar de asma e tabagismo materno foram mais comuns entre as crianças com sibilância de início tardio ou com sibilância persistente, e 43,9% deste último grupo apresentavam cor da pele não-branca. Bronquiolite no primeiro ano de vida foi mais comum no grupo com sibilância transitória.
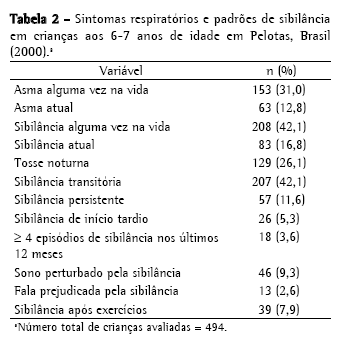
A prevalência de asma e sintomas respiratórios é apresentada na Tabela 2, e os valores de função pulmonar são apresentados na Tabela 3. A prevalência de diagnóstico médico de asma atual em crianças de 6 a 7 anos de idade foi de 12,8%. Entretanto, nos últimos 12 meses, 16,8% das crianças tinham apresentado sibilância, e 3,6% haviam tido pelo menos quatro episódios de sibilância. Os valores de função pulmonar estavam dentro da faixa de normalidade para todas as crianças estudadas. Para a identificação de qualquer potencial viés de seleção, as 143 crianças que foram submetidas aos testes foram comparadas a todas as outras crianças da coorte com base nos dados coletados no momento do nascimento. As crianças testadas não diferiram significativamente do restante da coorte em relação à cor da pele, sexo, renda familiar, escolaridade materna, nascimento prematuro, baixo peso ao nascer e tabagismo materno durante a gravidez (dados não mostrados).

A distribuição dos valores de função pulmonar de acordo com fatores sociais, biológicos e ambientais mostrou que as crianças não-brancas apresentaram valores de CVF e VEF1 menores que os observados para as crianças brancas. Não se encontraram diferenças estatísticas em relação a sexo, renda familiar, nascimento prematuro, baixo peso ao nascer e tabagismo materno.
A Tabela 4 mostra os resultados da regressão linear realizada para cada valor de função pulmonar e cada sintoma respiratório. As associações estatísticas foram ajustadas para sexo e cor da pele. As crianças com asma grave-definida como presença de pelo menos quatro episódios de sibilância nos últimos 12 meses, fala prejudicada pela sibilância e sono perturbado pela sibilância-apresentaram menores valores de função pulmonar, assim como as crianças com sibilância persistente. A média da relação VEF1/CVF foi menor nas crianças com sibilância atual e asma, asma alguma vez na vida, pelo menos quatro episódios de sibilância nos últimos 12 meses, sono perturbado pela sibilância e sibilância após exercícios.
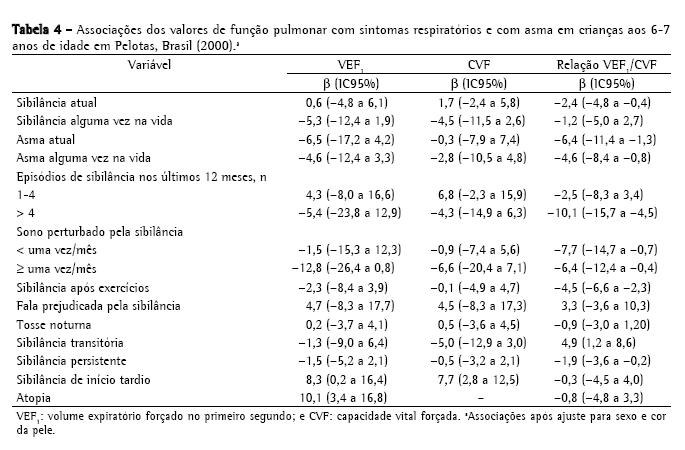
Sibilância persistente foi associada a redução da relação VEF1/CVF (β = −1,9, IC95%: −3,6 a −0,2); a média da relação VEF1/CVF nas crianças com sibilância transitória foi 4,9 pontos maior que nas outras crianças, e sibilância de início tardio apresentou associação positiva com VEF1, embora o número de crianças nesta categoria tenha sido pequeno (Tabela 4).
A regressão linear múltipla foi realizada para cada parâmetro de função pulmonar e cada sintoma respiratório para identificar sintomas com efeitos independentes sobre a função pulmonar. Os modelos foram ajustados para sexo, cor da pele e as outras variáveis estudadas. Cor da pele não-branca e fala prejudicada pela sibilância associaram-se independentemente a redução da média do VEF1. Após ajuste para todos os sintomas da asma, bem como para fatores sociais, ambientais e biológicos, verificamos que a relação VEF1/CVF associou-se positivamente a cor da pele não-branca e negativamente a sibilância após exercícios.
Menor escolaridade materna (< 8 anos de estudo), bronquiolite no primeiro ano de vida e história familiar de asma foram fatores de risco independentes para sibilância transitória. Cor da pele não-branca e renda familiar > 10 salários mínimos associaram-se independentemente à sibilância persistente, a última como um fator de proteção. Aos 6 anos de idade, as crianças com sibilância persistente apresentaram maior probabilidade de serem diagnosticadas com asma ou bronquiolite que as crianças com sibilância de início tardio (71,9% vs. 42,3%).
DiscussãoEste foi o primeiro estudo a investigar asma e função pulmonar em uma coorte de nascimentos de crianças brasileiras. A alta taxa de seguimento nesta coorte garante a representatividade da amostra estudada, e a comparação da amostra como um todo com a subamostra submetida a testes de função pulmonar e testes cutâneos evitou qualquer viés de seleção.
Das 494 crianças que participaram deste estudo de seguimento, 290 (58,7%) haviam tido episódios de sibilância antes dos 6 anos de idade. Essa proporção é mais alta que os 48.5% e os 35,3% relatados em dois estudos de coorte realizados nos Estados Unidos e Alemanha, respectivamente.(12,14) A coorte analisada no presente estudo foi mais comparável à coorte alemã, haja vista que a prevalência de sibilância transitória foi maior que 70% em ambos os estudos. A prevalência de sibilância de início tardio foi menor na presente coorte que nas outras coortes estudadas.
Sibilância persistente foi independentemente associada a cor da pele não-branca e renda familiar; as crianças das famílias que ganham > 10 salários mínimos estavam protegidas contra sibilância persistente. As crianças com sibilância persistente apresentaram redução da função pulmonar aos 6 anos de idade. Sibilância transitória foi associada a menor escolaridade materna (< 8 anos de estudo), bronquiolite no primeiro ano de vida, história familiar de asma e função pulmonar normal aos 6 anos. Os resultados de nossos testes de função pulmonar estão de acordo com os relatados em dois estudos anteriores,(12,14) embora a associação da sibilância persistente com renda familiar e com cor da pele não estava. Embora história familiar de asma tenha sido associada a todos os padrões de sibilância, na análise multivariada, descobriu-se que ela era um fator de risco para sibilância transitória apenas.
Em nossa amostra, a prevalência de asma atual aos 6 anos de idade foi de 12,8%, e 16,8% das crianças apresentaram sintomas de asma nessa idade. Aos 4 anos de idade, a prevalência de asma em nossa coorte foi de 18,4%, e 21,1% das crianças apresentaram sintomas de asma.(15) A redução da prevalência de asma entre 4 e 6 anos de idade não foi estatisticamente significativa. A prevalência de sintomas de asma grave foi menor no presente estudo que em um estudo anterior.(7)
Vários estudos têm demonstrado que a função pulmonar na infância pode predizer a função pulmonar na vida adulta.(16) Portanto, o entendimento da história natural da função pulmonar e seus possíveis fatores de risco é importante para a prevenção de doenças pulmonares.
Nossos resultados estão de acordo com os de Delacourt et al.(17) e os do estudo Tucson,(18) em que os sibilantes persistentes apresentaram FEFs menores que os observados para os sibilantes transitórios. Com base nesses resultados, Delacourt et al. concluiu que a asma infantil pode ser um fator de risco para perda precoce da função pulmonar, a qual é detectada aos 5 anos de idade e pode ser irreversível posteriormente.
Sabe-se também que algumas crianças asmáticas podem apresentar função pulmonar prejudicada e, portanto, podem apresentar risco de desenvolver doenças pulmonares no futuro. A razão para isso é controversa: uma hipótese é que crianças asmáticas perdem a retração elástica dos pulmões; outra é que crianças asmáticas apresentam perturbações do crescimento relacionadas a aumento do gasto energético em repouso ou a ingestão energética inadequada.(19,20)
No presente estudo, as crianças com sintomas respiratórios de asma apresentaram função pulmonar prejudicada. Como este foi um estudo longitudinal, foi possível avaliar os diferentes padrões de sibilância (transitória, persistente e de início tardio), conforme já descrito.(12) Embora a prevalência de asma e sintomas respiratórios tenha sido alta em nossa coorte, a maioria dessas crianças apresentou sibilância transitória, e não sibilância persistente ou de início tardio. O achado de que a função pulmonar estava prejudicada nas crianças de 6 a 7 anos de idade com sibilância persistente que não tinham apresentado sibilância transitória indica que a persistência da sibilância pode ser um marcador para risco na vida adulta.
A relação VEF1/CVF foi afetada pela asma, sendo que as crianças com sintomas de asma ou com diagnóstico de asma mostraram menor média de coeficientes. Reduções da relação VEF1/CVF foram vistas nas crianças com sibilância persistente, indicando que algumas crianças com sibilância já apresentam função pulmonar prejudicada nessa idade.
Outro achado interessante é que as crianças não-brancas apresentaram valores de VEF1 menores que os observados para as crianças brancas, mesmo após ajuste para fatores sócio-econômicos. Deve-se ressaltar que, aos 4 anos de idade, a prevalência de asma(15) também foi maior entre as crianças não-brancas que entre as crianças brancas. Uma grande parte dessa diferença é sabidamente devida a variações na relação entre o comprimento do tronco e das pernas, sendo que os negros tendem a ter pernas mais longas que os brancos da mesma altura.(21)
No presente estudo, atopia, avaliada utilizando-se testes cutâneos, não foi associada a função pulmonar prejudicada, conforme relatado em um estudo realizado no Peru.(22) Entretanto, a prevalência de atopia no presente estudo foi bastante alta. Embora a associação entre asma e atopia não seja um achado consistente na literatura,(23) pode-se especular que crianças com asma persistente têm déficits de função pulmonar, e não atopia.
Da mesma forma, dois outros grupos de pesquisadores descobriram que a função pulmonar em crianças asmáticas não foi influenciada pela atopia (17,24) Isso sugere que outros fatores, além da atopia, estão envolvidos no início da hiper-reatividade brônquica em crianças asmáticas.
Após ajuste para todas a outras variáveis, sibilância após exercícios foi o mais consistente fator de risco independente para função pulmonar prejudicada em nosso estudo, sendo que as crianças com sibilância após exercícios apresentaram uma redução média da relação VEF1/CVF de −4,4%. Isso também foi visto em um estudo envolvendo crianças de 7 a 8 anos de idade na Bélgica.(25)
Fala prejudicada pela sibilância, um marcador da gravidade da asma, também permaneceu significativo após a análise multivariada; as crianças com essa condição apresentaram uma redução do VEF1 de −18,1%. Esse efeito desapareceu após ajuste para outros parâmetros de função pulmonar, provavelmente em razão de fatores de confusão.
Crianças com função pulmonar prejudicada podem ser mais suscetíveis a fatores ambientais e podem apresentar um risco aumentado de função pulmonar declinante na vida adulta. Portanto, os asmáticos persistentes devem ser identificados e encaminhados para tratamento, de forma que a função pulmonar possa ser preservada e o prognóstico, melhorado. Estudos futuros devem ser realizados nessa população para analisar nosso achado de que a persistência de sibilância associou-se fortemente a renda familiar e cor da pele.
Referências 1. Sly RM. Changing prevalence of allergic rhinitis and asthma. Ann Allergy Asthma Immunol. 1999;82(3):233-48; quiz 248-52.
2. Sears MR. Epidemiology of childhood asthma. Lancet. 1997;350(9083):1015-20.
3. Jenkins MA, Hopper JL, Bowes G, Carlin JB, Flander LB, Giles GG. Factors in childhood as predictors of asthma in adult life. BMJ. 1994;309(6947):90-3.
4. Werneck G, Ruiz S, Hart R, White M, Romieu I. Prevalence of asthma and other childhood allergies in Brazilian schoolchildren. J Asthma. 1999;36(8):677-90.
5. De Britto MC, Bezerra PG, Ferreira OS, Maranhao IC, Trigueiro GA. Asthma prevalence in schoolchildren in a city in north-east Brazil. Ann Trop Paediatr. 2000;20(2):95-100.
6. Camargos PA, Castro RM, Feldman JS. Prevalence of symptoms related to asthma in school children of Campos Gerais, Brazil [Article in Spanish]. Rev Panam Salud Publica. 1999;6(1):8-15.
7. Chatkin MN, Menezes AM, Albernaz E, Victora CG, Barros FC. Fatores de risco para consultas em pronto-socorro por criancas asmaticas no Sul do Brasil. Rev Saúde Pública. 2000;34(5):491-8.
8. Roorda RJ, Gerritsen J, Van Aalderen WM, Schouten JP, Veltman JC, et al. Risk factors for the persistence of respiratory symptoms in childhood asthma. Am Rev Respir Dis. 1993;148(6 Pt 1):1490-5.
9. Strachan D, Gerritsen J. Long-term outcome of early childhood wheezing: population data. Eur Respir J Suppl. 1996;21:S42-S47.
10. Oswald H, Phelan PD, Lanigan A, Hibbert M, Bowes G, Olinsky A. Outcome of childhood asthma in mid-adult life. BMJ. 1994;309(6947):95-6.
11. Solé D, Vanna AT, Yamada E, Rizzo MC, Naspitz CK. International Study of Asthma and Allergies in Childhood (ISAAC) written questionnaire: validation of the asthma component among Brazilian children. J Investig Allergol Clin Immunol. 1998;8(6):376-82.
12. Martinez FD, Wright AL, Taussig LM, Holberg CJ, Halonen M, Morgan WJ. Asthma and wheezing in the first six years of life. The Group Health Medical Associates. N Engl J Med. 1995;332(3):133-8.
13. Standardization of Spirometry, 1994 Update. American Thoracic Society. Am J Respir Crit Care Med. 1995;152(3):1107-36.
14. Lau S, Illi S, Sommerfeld C, Niggemann B, Völkel K, Madloch C, et al. Transient early wheeze is not associated with impaired lung function in 7-yr-old children. Eur Respir J. 2003;21(5):834-41.
15. Chatkin MN, Menezes AM, Victora CG, Barros FC. High prevalence of asthma in preschool children in Southern Brazil: a population-based study. Pediatr Pulmonol. 2003;35(4):296-301.
16. Grol MH, Gerritsen J, Vonk JM, Schouten JP, Koëter GH, Rijcken B, et al. Risk factors for growth and decline of lung function in asthmatic individuals up to age 42 years. A 30-year follow-up study. Am J Respir Crit Care Med. 1999;160(6):1830-7.
17. Delacourt C, Benoist MR, Le Bourgeois M, Waernessyckle S, Rufin P, Brouard JJ, et al. Relationship between bronchial hyperresponsiveness and impaired lung function after infantile asthma. PLoS ONE. 2007;2(11):e1180.
18. Morgan WJ, Stern DA, Sherrill DL, Guerra S, Holberg CJ, Guilbert TW, et al. Outcome of asthma and wheezing in the first 6 years of life: follow-up through adolescence. Am J Respir Crit Care Med. 2005;172(10):1253-8.
19. Hauspie R, Susanne C, Alexander F. Maturational delay and temporal growth retardation in asthmatic boys. J Allergy Clin Immunol. 1977;59(3):200-6.
20. Merkus PJ, van Essen-Zandvliet EE, Kouwenberg JM, Duiverman EJ, Van Houwelingen HC, Kerrebijn KF, et al. Large lungs after childhood asthma. A case-control study. Am Rev Respir Dis. 1993;148(6 Pt 1):1484-9.
21. Hankinson JL, Odencrantz JR, Fedan KB. Spirometric reference values from a sample of the general U.S. population. Am J Respir Crit Care Med. 1999;159(1):179-87.
22. Penny ME, Murad S, Madrid SS, Herrera TS, Piñeiro A, Caceres DE, et al. Respiratory symptoms, asthma, exercise test spirometry, and atopy in schoolchildren from a Lima shanty town. Thorax. 2001;56(8):607-12.
23. Pearce N, Pekkanen J, Beasley R. How much asthma is really attributable to atopy? Thorax. 1999;54(3):268-72.
24. Yang E, Kim W, Kwon BC, Choi SY, Sohn MH, Kim KE. Relationship among pulmonary function, bronchial hyperresponsiveness, and atopy in children with clinically stable asthma. Lung. 2006;184(2):73-9.
25. Droste JH, Wieringa MH, Weyler JJ, Nelen VJ, Van Bever HP, Vermeire PA. Lung function measures and their relationship to respiratory symptoms in 7- and 8-year-old children. Pediatr Pulmonol. 1999;27(4):260-6.
Trabalho realizado na Escola de Saúde da Universidade Católica de Pelotas - UCPel - e no Departamento de Clínica Médica da Universidade Federal de Pelotas - UFPel - Pelotas (RS) Brasil.
1. Diretora da Escola de Saúde da Universidade Católica de Pelotas - UCPel - Pelotas (RS) Brasil.
2. Professora Titular do Departamento de Clínica Médica da Universidade Federal de Pelotas - UFPel - Pelotas (RS) Brasil.
3. Professora do Departamento de Clínica Médica da Universidade Federal de Pelotas - UFPel - Pelotas (RS) Brasil.
4. Médico do Departamento de Clínica Médica da Universidade Federal de Pelotas - UFPel - Pelotas (RS) Brasil.
Endereço para correspondência: Moema Nudilemon Chatkin. Gonçalves Chaves, 3625/304, CEP 96015-560, Pelotas (RS) Brasil.
Tel 53 2128-8501. E-mail: moemachatkin@gmail.com
Apoio financeiro: Nenhum.
Recebido para publicação em 3/6/2007. Aprovado, após revisão, em 11/2/2008.







