ABSTRACT
Objective: To evaluate the accuracy of determining specific IgA to HspX recombinant antigen in pleural fluid and serum samples for the diagnosis of pleural tuberculosis in patients with pleural effusion. Methods: This was a cross-sectional study. Serum and pleural fluid samples of patients with pleural effusion and suspected of having pleural tuberculosis were tested with indirect ELISA in order to determine the optical density of specific IgA to HspX. Results: We evaluated serum and pleural fluid samples from 132 patients: 97 diagnosed with pleural tuberculosis (study group) and 35 diagnosed with pleural effusion due to other causes (control group). The determination of IgA in pleural fluid satisfactorily discriminated between pleural tuberculosis patients and control patients. The sensitivity of the test in pleural fluid and in serum was 69% and 30%, respectively, whereas the specificity was 83% and 84%, respectively. Conclusions: Our data suggest that this test can be used in the diagnosis of pleural tuberculosis. Further studies, involving larger patient samples and different epidemiological scenarios, are warranted.
Keywords:
Pleural effusion; Tuberculosis/diagnosis; Enzyme-linked immunosorbent assay.
RESUMO
Objetivo: Avaliar a acurácia da dosagem de IgA contra o antígeno recombinante HspX no líquido pleural e no soro de pacientes com derrame pleural para o diagnóstico de tuberculose pleural. Métodos: Estudo transversal de teste diagnóstico. Amostras de líquido pleural e de soro de pacientes com derrame pleural e suspeita de tuberculose pleural foram avaliadas para a determinação da densidade óptica de IgA contra HspX utilizando ELISA indireto. Resultados: Foram avaliadas amostras de líquido pleural e de soro de 132 pacientes: 97 com tuberculose pleural (grupo de estudo) e 35 com derrame pleural por outras causas (grupo controle). A dosagem de IgA em líquido pleural foi capaz de discriminar os pacientes com tuberculose pleural dos controles. A sensibilidade do teste em líquido pleural e em soro foi, respectivamente, de 69% e 30%, enquanto a especificidade foi de 83% e 84%, respectivamente. Conclusões: Os dados sugerem o potencial da utilização deste teste no diagnóstico de tuberculose pleural. Estudos com amostras maiores e em diferentes cenários epidemiológicos são necessários.
Palavras-chave:
Derrame pleural; Tuberculose/diagnóstico; ELISA.
IntroduçãoO Brasil é um dos 22 países responsáveis por cerca de 80% dos casos de tuberculose (TB) no mundo e o detentor do maior número de casos da América Latina.(1) A TB se distribui em formas pulmonares (cerca de 85%) e extrapulmonares (cerca de 14%). Entre os casos de TB extrapulmonar, a doença pleural é a mais frequente em indivíduos com sorologia negativa para HIV.(1,2)
O método diagnóstico de melhor rendimento em pacientes com TB pleural é a histologia combinada com a cultura de fragmento pleural, obtido por biópsia. No entanto, a obtenção de fragmento de pleura implica na realização de um método invasivo, e a cultura demanda um tempo mínimo de três semanas.(3-5) Em função disso, testes mais rápidos e que sejam pouco ou não invasivos vêm sendo pesquisados para o diagnóstico de TB pleural.
Estudos recentes demonstraram que a presença do antígeno recombinante HspX (rHspX) - Rv2031c - no soro pode se relacionar tanto com a TB na sua fase de infecção latente quanto na de doença pulmonar ativa.(6,7) Por outro lado, já foi demonstrado que, entre as várias citocinas induzidas pelo Mycobacterium tuberculosis, se encontra a TGF-, que está aumentada em pacientes portadores de TB pleural e que está envolvida na regulação da resposta imune celular e na indução da produção de IgA.(8,9)
Baseado no exposto, foi elaborado um estudo com o objetivo de avaliar a acurácia da dosagem de IgA contra o antígeno rHspX no líquido pleural (LP) e no soro de pacientes com derrame pleural, utilizando a técnica de ELISA indireta, para o diagnóstico de TB pleural.
MétodosForam elegíveis para participar do estudo todos os indivíduos atendidos consecutivamente no setor de métodos especiais do Instituto de Doenças do Tórax da Universidade Federal do Rio de Janeiro, entre setembro de 2002 e julho de 2007, e que foram encaminhados para a realização de toracocentese e biópsia de pleura devido a suspeita clínica e radiológica de TB pleural. Para este estudo, foi utilizada uma amostra de conveniência.
Foram incluídos no estudo de forma sequencial os indivíduos que atendiam aos seguintes critérios de inclusão: idade igual ou superior a 12 anos; presença de derrame pleural líquido livre, conforme demonstrado por radiografia de tórax em decúbito lateral; índice de Karnofsky ≥ 60%; e adesão ao estudo através da assinatura do termo de consentimento livre e esclarecido. Foram excluídos do estudo os pacientes com evidência clínica e/ou laboratorial de falência renal, cardíaca ou hepática, aqueles com história de uso de anticoagulantes ou de ácido acetilsalicílico nos 10 dias anteriores ao procedimento e aqueles que não tiveram diagnóstico confirmado após a investigação e/ou que não completaram algum dos procedimentos do estudo.
Todos os pacientes foram submetidos a entrevista padronizada, exame físico, radiografia de tórax em incidência póstero-anterior e em decúbito lateral, além de toracocentese, biópsia pleural com agulha de Cope e escarro induzido (EI). O EI foi realizado conforme previamente descrito.(10) O derrame pleural foi classificado como exsudato ou não exsudato, baseado nos critérios de Light et al.(11) O derrame foi considerado linfocítico se a dosagem de linfócitos fosse superior a 80%. Uma amostra de 5 ml de LP, dois fragmentos pleurais e o material obtido através de EI foram corados com Ziehl-Neelsen. As amostras foram cultivadas nos meios de Löwenstein-Jensen e de Sabouraud seguindo os protocolos padrões.(12) Outros três fragmentos pleurais foram corados com HE, e o LP foi corado com Papanicolaou. Todos os espécimes com cultura positiva para micobactérias foram testados por métodos bioquímicos para distinguir M. tuberculosis de outras micobactérias causadoras de TB. Aproximadamente 500 µl de LP e 500 µl de sangue foram coletados e imediatamente congelados a −20°C para a posterior realização do teste ELISA.
Foram diagnosticados com TB pleural aqueles indivíduos que apresentaram um ou mais dos seguintes critérios: 1. crescimento de M. tuberculosis no LP e/ou no fragmento pleural e/ou na amostra de escarro; 2. presença de granuloma com ou sem necrose de caseificação no tecido pleural; 3. presença de derrame pleural exsudativo linfocitário, com citologia negativa para células malignas, havendo regressão completa do quadro clínico e radiológico após o tratamento com rifampicina, isoniazida e pirazinamida.
Dessa forma, foram selecionadas 132 amostras de soro e de LP de pacientes com derrame pleural para o estudo, sendo 97 amostras de pacientes com TB pleural e 35 amostras de pacientes com outras doenças que não TB (28 pacientes com câncer metastático, 1 paciente com insuficiência cardíaca congestiva, 2 pacientes com insuficiência hepática, 1 paciente com lúpus eritematoso sistêmico e 3 pacientes com derrame parapneumônico).
A detecção de anticorpos IgA contra o antígeno rHspX do LP e do soro foi realizada seguindo a técnica ELISA, conforme previamente descrito, mas com algumas modificações após a padronização.(13) Para a efetivação do ensaio, o antígeno foi diluído em tampão carbonato/bicarbonato (pH = 9,6), em uma concentração final de 2,5 µg/ml (50 µl/poço) e incubado por 18 h a 4°C nas placas de ELISA. Posteriormente, acrescentou-se 50 ml de tampão carbonato/bicarbonato 0,05 M com leite desnatado em pó a 1% seguido de incubação por mais 2 h à temperatura de 37°C. O soro e o LP foram diluídos em PBS e leite desnatado a 0,1% em diluições de 1/100 e 1/10, respectivamente, e incubados em estufa a 37°C (por 2 h para amostras de soro e por 24 h para amostras de LP). As placas foram lavadas seis vezes com PBS e Tween 20 a 0,05%. As soluções contendo os anticorpos anti-IgA totais humanos conjugados com peroxidase foram diluídas em PBS e leite desnatado a 0,05%, em uma diluição final de 1/2.000, distribuídas em cada poço (50 µl) e incubadas em estufa a 37°C por 1 h. Após esse período, as placas foram novamente lavadas com PBS e Tween 20 a 0,05%. O tampão substrato (solução de 5 mg de ortofenilenodiamina, 20 µl de peróxido de oxigênio e 5 ml de tampão citrato/fosfato pH = 5,2) foi pipetado e incubado por 15 min e, a seguir, 50 µl de solução de ácido sulfúrico 4N foram adicionados em cada poço. Os resultados dos testes ELISA foram fornecidos em forma de valores de densidade óptica, obtidos através de um leitor de ELISA (Thermo Lab Systems, Franklin, MA, EUA) em comprimento de onda de 492 nm. Os procedimentos foram realizados no Laboratório de Imunopatologia das Doenças Infecciosas do Instituto de Patologia Tropical e Saúde Pública da Universidade Federal de Goiás.
Os dados foram analisados com os programas GraphPad Prism versão 4.02 (GraphPad Software, San Diego, CA, EUA) e Microsoft Excel 2003. Para a determinação do ponto de corte da densidade ótica que permitisse a melhor sensibilidade e especificidade dos testes no LP e no soro, foi utilizada a curva ROC, considerando como melhor ponto de corte aquele mais próximo da parte superior esquerda da curva (sensibilidade e especificidade de 100%). As medianas foram comparadas através do teste de Mann-Whitney.(14) Adotou-se o nível de significância de 5%.
O projeto foi aprovado pela Comissão de Ética do Hospital Universitário Clementino Fraga Filho/Instituto de Doenças de Tórax da Universidade Federal do Rio de Janeiro.
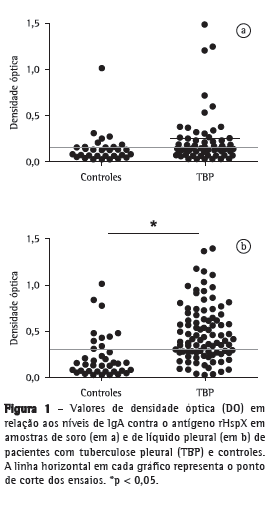
ResultadosForam avaliados 175 indivíduos com derrame pleural e suspeita de TB pleural. Desses, 43 pacientes foram excluídos do estudo: 13 por hemólise das amostras e 30 por diagnóstico final desconhecido. Portanto, foram selecionados 132 pacientes, 97 dos quais diagnosticados com TB pleural e 35 diagnosticados com outras doenças que não TB (câncer metastático, insuficiência cardíaca congestiva, insuficiência hepática, lúpus eritematoso sistêmico e derrame parapneumônico), formando o grupo controle. As amostras de soro e de LP desses pacientes foram avaliadas. A Tabela 1 mostra o perfil dos indivíduos incluídos no presente estudo. Na Figura 1, são apresentados os resultados dos valores das densidades óticas do teste ELISA indireto no soro e no LP. Os níveis de IgA no soro (Figura 1a) de pacientes com TB pleural foram mais elevados do que no soro de pacientes do grupo controle (0,244 ± 0,377 vs. 0,137 ± 0,174), mas a diferença não foi estatisticamente significante (p > 0,05). No entanto, conforme apresentado na Figura 1b, a dosagem de IgA foi significativamente mais elevada no LP de pacientes com TB pleural que no LP de pacientes no grupo controle (0,481 ± 0,300 vs. 0,203 ± 0,204; p < 0,05).

Na Tabela 2 são apresentados os valores discriminatórios encontrados através da curva ROC, tanto para avaliação do teste no soro, quanto para a avaliação do teste no LP. Para o diagnóstico de TB pleural na amostra estudada, a sensibilidade, a especificidade e o valor preditivo positivo do teste no LP apresentaram melhor desempenho global do que os valores correspondentes do teste no soro.
 Discussão
DiscussãoO ensaio ELISA para a pesquisa da IgA no LP contra o antígeno rHspX foi capaz de discriminar pacientes com derrame pleural devido à TB daqueles pacientes com derrame pleural devido a outras doenças. Além disso, esse ensaio apresentou sensibilidade de 69%, superior à sensibilidade do teste convencional para o diagnóstico de TB no LP, que é a cultura para M. tuberculosis, que varia de 10% a 20% nas diferentes séries.(3,15)
A detecção de imunoglobulinas é relativamente simples e tem baixo custo. Em função disso, sua avaliação do soro, no LP e em outras amostras para o diagnóstico de TB tem sido estudada há tempos.(16) O teste ELISA é uma técnica sensível, reprodutível, segura, de fácil execução e que não requer instrumentos sofisticados e caros, o que quer dizer que pode ser facilmente realizado em qualquer laboratório. No entanto, embora promissores, os estudos com antígenos purificados no soro para o diagnóstico de TB pulmonar ainda não apresentaram valores de acurácia que justificassem sua incorporação à prática médica de rotina.(17-20) Da mesma forma, na TB extrapulmonar, em uma meta-análise realizada em 2007, demonstrou-se que, nos ensaios imunoenzimáticos nos quais o LP foi avaliado, a sensibilidade dos testes variou de 26% a 59%, e a especificidade variou de 81% a 100%.(21) Os autores concluíram que apesar de rápidos, simples e não invasivos, não havia evidências que justificassem seu uso no diagnóstico de TB extrapulmonar.(21) No entanto, nenhum dos testes avaliados naquela meta-análise utilizou a dosagem de IgA contra o antígeno rHspX no LP. Em outra meta-análise realizada em 2009, avaliou-se o desempenho de testes sorológicos para TB pulmonar.(22) Em 25 estudos, a média da sensibilidade encontrada foi de 40% (variação: 10-90%), e a média de especificidade foi de 96% (variação: 48-100%), valores semelhantes aos encontrados no teste no soro no presente estudo, que foram de 30% (IC95%: 16-49) e 84% (IC95%: 74-83), respectivamente. Em nosso estudo, contudo, a dosagem de IgA do soro contra o antígeno rHspX não foi capaz de discriminar os pacientes com TB pleural dos controles, sugerindo que a resposta humoral sérica não é tão significativa quanto à resposta local, ou seja, no LP (Figura 1a).
Em relação ao antígeno utilizado neste estudo, rHspX, um estudo preliminar já havia concluído, através de ensaio immunoblot, que tanto as proteínas de 27 KDa, quanto às de 16 kDa (como é o caso de rHspX) são reconhecidas no soro de pacientes com TB ativa e não reconhecidas no soro de controles sem TB ativa.(23) Apesar disso, um estudo anterior sugerira uma maior resposta ao antígeno rHspX no soro de indivíduos com infecção latente por M. tuberculosis do que em pacientes com TB ativa.(13) Embora em um estudo recente também se tenha demonstrado uma maior resposta a esse antígeno em indivíduos com infecção latente por M. tuberculosis, os autores ressaltaram que o rHspX seria uma proteína do M. tuberculosis com capacidade de se expressar nos diferentes estágios da TB, ou seja, da infecção por M. tuberculosis até a doença ativa.(23)
Como visto, as diversas publicações sugerem que, embora o ensaio imunoenzimático tenha potencial tanto para a detecção de infecção latente por M. tuberculosis quanto para detecção de TB doença ativa pulmonar ou extrapulmonar, nenhum teste mostrou ainda uma acurácia que justificasse sua utilização. Os resultados obtidos no LP utilizando IgA e o antígeno rHspX no presente estudo reacendem essa discussão e estimulam a realização de novos estudos nessa linha. Seria interessante que ensaios utilizando amostras maiores e grupos controles com um maior número de casos de derrame pleural líquido devido a outros agentes infecciosos, os quais podem se confundir clinica e radiologicamente com TB, assim como também de casos de indivíduos com comprometimento imune, fossem incluídos. É interessante lembrar que a utilização de outros antígenos combinados com rHspX pode aumentar a sensibilidade do teste em até 20% e que esse é um recurso adicional a ser empregado em futuros estudos.(24).
Embora, até onde seja do nosso conhecimento, este ensaio seja o primeiro a avaliar a dosagem de IgA contra o antígeno rHspX no LP para o diagnóstico de TB pleural em nosso meio e os resultados sejam encorajadores, o estudo tem algumas limitações. A amostra estudada foi de indivíduos com derrame pleural líquido e suspeita clínica e radiológica de TB pleural, em uma área com elevada prevalência de TB. Esse viés de seleção influenciou a prevalência de TB na amostra e, consequentemente, os valores preditivos do teste. Adicionalmente, o presente estudo utilizou uma amostra de conveniência, e o largo intervalo de confiança da sensibilidade e da especificidade do teste sugere que o tamanho amostral utilizado no estudo talvez pudesse ser maior, sobretudo o grupo controle. Assim, é importante que estudos semelhantes sejam realizados em diferentes cenários epidemiológicos, utilizando um tamanho amostral maior. Outra limitação do estudo é que a rotina de avaliação de pacientes com derrame pleural suspeito de TB no nosso hospital não inclui a dosagem de adenosina desaminase. A falta desse teste para a comparação com o teste realizado pode ser considerada uma limitação para a avaliação dos nossos resultados.
Em conclusão, o ensaio utilizando o teste ELISA indireto para a dosagem de IgA no LP contra rHspX de M. tuberculosis foi capaz de discriminar os pacientes com derrame pleural devido a TB pleural daqueles com derrame pleural devido a outras doenças. A boa acurácia demonstrada pelo teste sugere fortemente que essa linha de pesquisa deva ser continuada. No entanto, novos estudos com amostras maiores, mais diversificadas e em diferentes cenários epidemiológicos são necessários antes da incorporação desse teste na prática médica de rotina.
Referências 1. World Health Organization. Global Tuberculosis Control Epidemiology, Strategy, Financing: WHO report 2009. Geneva: WHO/HTM/TB; 2009.
2. Seibert AF, Haynes J Jr, Middleton R, Bass JB Jr. Tuberculous pleural effusion. Twenty-year experience. Chest. 1991;99(4):883-6.
3. Seiscento M, Conde MB, Dalcolmo MM. Tuberculous pleural effusions [Article in Portuguese]. J Bras Pneumol. 2006;32 Suppl 4:S174-81.
4. Sociedade Brasileira de Pneumologia e Tisiologia. III Diretrizes para Tuberculose da Sociedade Brasileira de Pneumologia e Tisiologia. J Bras Pneumol. 2009;35(10):1018-48.
5. Donath J. From magic mountains to modern times. A view from the community hospital. Chest. 1997;111(5):1153-5.
6. Jackett PS, Bothamley GH, Batra HV, Mistry A, Young DB, Ivanyi J. Specificity of antibodies to immunodominant mycobacterial antigens in pulmonary tuberculosis. J Clin Microbiol. 1988;26(11):2313-8.
7. Lee BY, Hefta SA, Brennan PJ. Characterization of the major membrane protein of virulent Mycobacterium tuberculosis. Infect Immun. 1992;60(5):2066-74.
8. Abbas AK, Lichtman AH. Ativação da Célula B e Produção de Anticorpos. In: Abbas AK, Lichtman AH, Pillai S. Imunologia Celular e Molecular. Rio de Janeiro: Elsevier; 2005. p. 212-4.
9. Seiscento M, Vargas FS, Antonangelo L, Acencio MM, Bombarda S, Capelozzi VL, et al. Transforming growth factor beta-1 as a predictor of fibrosis in tuberculous pleurisy. Respirology. 2007;12(5):660-3.
10. Bigby TD, Margolskee D, Curtis JL, Michael PF, Sheppard D, Hadley WK, et al. The usefulness of induced sputum in the diagnosis of Pneumocystis carinii pneumonia in patients with the acquired immunodeficiency syndrome. Am Rev Respir Dis. 1986;133(4):515-8.
11. Light RW, Macgregor MI, Luchsinger PC, Ball WC Jr. Pleural effusions: the diagnostic separation of transudates and exudates. Ann Intern Med. 1972;77(4):507-13.
12. Kent PT, Kubica GP. Public Health Mycobacteriology: A Guide for the Level III Laboratory. Atlanta: U.S. Dept. of Health and Human Services, Public Health Service, Centers for Disease Control; 1985.
13. Rabahi MF, Junqueira-Kipnis AP, Dos Reis MC, Oelemann W, Conde MB. Humoral response to HspX and GlcB to previous and recent infection by Mycobacterium tuberculosis. BMC Infect Dis. 2007;7:148.
14. Haynam GE, Govindarajulu Z. Exact Power of Mann-Whitney Test for Exponential and Rectangular Alternatives. Ann Math Stat. 1966;37(4):945-53.
15. Conde MB, Loivos AC, Rezende VM, Soares SL, Mello FC, Reingold AL, et al. Yield of sputum induction in the diagnosis of pleural tuberculosis. Am J Respir Crit Care Med. 2003;167(5):723-5.
16. Daniel TM, Debanne SM. The serodiagnosis of tuberculosis and other mycobacterial diseases by enzyme-linked immunosorbent assay. Am Rev Respir Dis. 1987;135(5):1137-51.
17. Chiang IH, Suo J, Bai KJ, Lin TP, Luh KT, Yu CJ, et al. Serodiagnosis of tuberculosis. A study comparing three specific mycobacterial antigens. Am J Respir Crit Care Med. 1997;156(3 Pt 1):906-11.
18. Demkow U, Ziółkowski J, Filewska M, Białas-Chromiec B, Zielonka T, Michałowska-Mitczuk D, et al. Diagnostic value of different serological tests for tuberculosis in Poland. J Physiol Pharmacol. 2004;55 Suppl 3:57-66.
19. Okuda Y, Maekura R, Hirotani A, Kitada S, Yoshimura K, Hiraga T, et al. Rapid serodiagnosis of active pulmonary Mycobacterium tuberculosis by analysis of results from multiple antigen-specific tests. J Clin Microbiol. 2004;42(3):1136-41.
20. Melo Cardoso Almeida C, Vasconcelos AC Jr, Kipnis A, Andrade AL, Junqueira-Kipnis AP. Humoral immune responses of tuberculosis patients in Brazil indicate recognition of Mycobacterium tuberculosis MPT-51 and GlcB. Clin Vaccine Immunol. 2008;15(3):579-81.
21. Steingart KR, Henry M, Laal S, Hopewell PC, Ramsay A, Menzies D, et al. A systematic review of commercial serological antibody detection tests for the diagnosis of extrapulmonary tuberculosis. Thorax. 2007;62(10):911-8.
22. Steingart KR, Dendukuri N, Henry M, Schiller I, Nahid P, Hopewell PC, et al. Performance of purified antigens for serodiagnosis of pulmonary tuberculosis: a meta-analysis. Clin Vaccine Immunol. 2009;16(2):260-76.
23. Raja A, Ranganathan UD, Ramalingam B. Clinical value of specific detection of immune complex-bound antibodies in pulmonary tuberculosis. Diagn Microbiol Infect Dis. 2006;56(3):281-7.
24. Silva VM, Kanaujia G, Gennaro ML, Menzies D. Factors associated with humoral response to ESAT-6, 38 kDa and 14 kDa in patients with a spectrum of tuberculosis. Int J Tuberc Lung Dis. 2003;7(5):478-84.
* Trabalho realizado no Laboratório de Imunopatologia das Doenças Infecciosas, Instituto de Patologia Tropical e Saúde Pública, Universidade Federal de Goiás, Goiânia (GO) Brasil.
Endereço para correspondência: Ana Paula Junqueira-Kipnis. Rua 325 esquina com Primeira Avenida, sala 325, Setor Universitário, CEP 74605-050, Goiânia, GO, Brasil.
Tel. 55 62 3209-6126. E-mail: loanda9@hotmail.com
Apoio financeiro: Este estudo recebeu apoio financeiro do Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) e da Fundação de Amparo à Pesquisa do Estado de Goiás (FAPEG).
Recebido para publicação em 18/1/2011. Aprovado, após revisão, em 21/3/2011.
Sobre os autoresLoanda Carvalho Sant' Ana Limongi
Farmacêutica. Laboratório de Imunopatologia das Doenças Infecciosas, Instituto de Patologia Tropical e Saúde Pública, Universidade Federal de Goiás, Goiânia (GO) Brasil.
Liliane Olival
Mestranda. Departamento de Clínica Médica, Faculdade de Medicina da Universidade Federal do Rio de Janeiro, Rio de Janeiro (RJ) Brasil.
Marcus Barreto Conde
Professor Adjunto. Instituto de Doenças do Tórax, Universidade Federal do Rio de Janeiro, Rio de Janeiro (RJ) Brasil.
Ana Paula Junqueira-Kipnis
Professora Associada. Universidade Federal de Goiás, Goiânia (GO) Brasil.






