ABSTRACT
Objective: To evaluate diaphragmatic mobility in relation to lung function, respiratory muscle strength, dyspnea, and physical activity in daily life (PADL) in patients with COPD. Methods: We included 25 patients with COPD, classified according to the Global Initiative for Chronic Obstructive Lung Disease criteria, and 25 healthy individuals. For all of the participants, the following were evaluated: anthropometric variables, spirometric parameters, respiratory muscle strength, diaphragmatic mobility (by X-ray), PADL, and the perception of dyspnea. Results: In the COPD group, diaphragmatic mobility was found to correlate with lung function variables, inspiratory muscle strength, and the perception of dyspnea, whereas it did not correlate with expiratory muscle strength or PADL. Conclusions: In patients with COPD, diaphragmatic mobility seems to be associated with airway obstruction and lung hyperinflation, as well as with ventilatory capacity and the perception of dyspnea, although not with PADL.
Keywords:
Pulmonary disease, chronic obstructive; Diaphragm; Spirometry; Dyspnea; Maximal respiratory pressures.
RESUMO
Objetivo: Avaliar a relação da mobilidade diafragmática com a função pulmonar, força muscular respiratória, dispneia e atividade física de vida diária (AFVD) em pacientes com DPOC. Métodos: Foram avaliados 25 pacientes com diagnóstico de DPOC, classificados de acordo com critérios da Global Initiative for Chronic Obstructive Lung Disease, e 25 indivíduos saudáveis. Todos foram submetidos às seguintes avaliações: mensuração antropométrica, espirometria, força muscular respiratória, mobilidade diafragmática (por radiografia), AFVD e percepção de dispneia. Resultados: No grupo DPOC, houve correlações da mobilidade diafragmática com variáveis de função pulmonar, força muscular inspiratória e percepção de dispneia. Não houve correlações da mobilidade diafragmática com força muscular expiratória e AFVD. Conclusões: A mobilidade diafragmática parece estar associada tanto com a obstrução das vias aéreas quanto com a hiperinsuflação pulmonar em pacientes com DPOC, assim como com a capacidade ventilatória e percepção de dispneia, mas não com AFVD.
Palavras-chave:
Doença pulmonar obstrutiva crônica; Diafragma; Espirometria; Dispneia e Pressões respiratórias máximas.
INTRODUÇÃOAlguns autores já descreveram a redução da mobilidade diafragmática (MD) em pacientes com DPOC.(1-4) Contudo, a DPOC também gera consequências extrapulmonares significativas,(5) que resultam em inflamação sistêmica, perda da massa muscular,(6,7) desnutrição, depressão(8) e descondicionamento físico,(9) reduzindo, dessa forma, o estado de saúde desses indivíduos.(10)
Apesar de todo o comprometimento sistêmico da DPOC, poucos estudos foram realizados para investigar a relação entre a MD e as alterações sistêmicas causadas pela doença. Entretanto, a relação da MD com a distância percorrida no teste da caminhada de seis minutos,(2,11) com a dispneia(2) e com a mortalidade(12) já foi descrita.
Além disso, alguns estudos demonstraram que a MD pode estar associada com alterações da função pulmo-nar.(3,11,13) Recentemente Davachi et al.(11) observaram que pacientes classificados como com DPOC grau leve apre-sentaram maior MD quando comparados aos pacientes classificados como com grau muito grave. Os mesmos auto-res também observaram relações entre a MD com a CVF e CV lenta (CVL). Em alguns estudos prévios, observou-se a associação entre a MD e o aprisionamento aéreo,(3,14,15) a ventilação voluntária máxima (VVM)(3) e a hiperinsuflação pulmonar.(1) Esses resultados fortalecem a hipótese de que a redução da MD pode estar relacionada com a gravida-de da doença pulmonar.
Entretanto, não existem estudos na literatura que investiguem a relação da MD com a atividade física de vida diá-ria (AFVD) e são poucos os estudos que relacionam a MD com dispneia e função pulmonar.(2,3) Dessa forma, o obje-tivo principal do estudo foi avaliar a relação da MD com a função pulmonar, dispneia e AFVD em pacientes com DPOC, bem como comparar os valores de função pulmonar, força muscular respiratória e MD entre pacientes com DPOC e indivíduos saudáveis.
MÉTODOSO estudo se caracteriza por ser do tipo descritivo, transversal e de abordagem quantitativa. Foi aprovado pelo co-mitê de ética e pesquisa em seres humanos da instituição sob o número CAEE 08871312.7.0000.0118. Todos os participantes foram previamente esclarecidos sobre o estudo e assinaram o termo de consentimento livre e esclare-cido. A amostra foi formada por 25 pacientes com DPOC (14 do sexo masculino e 11 do sexo feminino) e 25 indiví-duos saudáveis (5 do sexo masculino e 20 do sexo feminino). Foram incluídos pacientes com diagnóstico de DPOC segundo a classificação do Global Initiative for Chronic Obstructive Lung Disease de 2015(9) e que preencheram os seguintes critérios: 1) inexistência de outras doenças pulmonares, cardiovasculares ou musculoesqueléticas associ-adas; 2) pacientes sem envolvimento em programas de treinamento nos 6 meses anteriores ao início do presente estudo; 3) pacientes não dependentes de suplementação de oxigenoterapia; e 4) não ser tabagista atualmente. Já os indivíduos saudáveis preencheram os seguintes critérios de inclusão: 1) prova de função pulmonar normal (VEF1/CVF ≥ 0,7; VEF1 ≥ 80% do previsto; CVF ≥ 80% do previsto); 2) não ser tabagista; e 3) ausência de doenças cardiorres-piratórias, hepáticas, neurológicas ou oncológicas. Foram considerados critérios de exclusão: 1) incapacidade de realizar qualquer uma das avaliações do estudo (falta de compreensão ou colaboração); 2) exacerbação da doença durante a pesquisa; 3) intercorrências clínicas de natureza cardiorrespiratória e/ou musculoesqueléticas durante as avaliações; e 4) índice de massa corpórea (IMC) > 30 kg/m2 (indivíduos obesos).
Espirometria e força muscular respiratóriaA espirometria foi realizada com um espirômetro digital portátil EasyOne® (ndd Medical Technologies, Andover, MA, EUA) previamente calibrado, de acordo com os métodos e critérios recomendados pela American Thoracic Soci-ety e European Respiratory Society.(16) Foram mensurados os seguintes parâmetros: CVF, VEF1, relação VEF1/CVF antes e 15 minutos depois da inalação de broncodilatador (salbutamol, 400 µg) e a capacidade inspiratória (CI). Foram realizadas no mínimo três manobras aceitáveis e duas reprodutíveis, exceto na determinação da CI, durante a qual foi realizada a média de três manobras, conforme relatado por Miller et al.(16) As variáveis espirométricas estão expressas em valores absolutos e em valor percentual dos valores previstos de normalidade, segundo os determi-nados por Pereira et al.(17)
Para a mensuração da força muscular inspiratória e expiratória foi utilizado um manovacuômetro digital MVD500® (Globalmed, Porto Alegre, Brasil) acoplado a um bocal com orifício de escape de 1 mm de diâmetro. A PImáx e a PEmáx foram medidas como indicadores de forças musculares inspiratória e expiratória, respectivamente, seguindo as diretrizes da Sociedade Brasileira de Pneumologia e Tisiologia.(18) A PImáx foi mensurada após uma expiração máxima próxima ao VR, enquanto que a PEmáx foi mensurada após uma inspiração máxima próxima da CPT. Foram realizadas no mínimo três manobras aceitáveis e duas reprodutíveis. Os valores de PImáx e PEmáx estão expressos em valores absolutos e em valores percentuais dos valores previstos de normalidade, segundo os determinados por Neder et al.(19) O valor considerado para o estudo foi a média das variáveis reprodutíveis.
MDInicialmente os pacientes foram submetidos a uma familiarização da respiração diafragmática para desenvolver propriocepção do movimento diafragmático e possibilitar a avaliação máxima da amplitude do diafragma durante o exame de radiografia. Foram solicitadas duas séries de dez repetições de respirações diafragmáticas com o estímulo de propriocepção dado pelas mãos no tórax e no abdome e estímulo verbal para direcionar o ar para a região basal do tórax, conforme utilizado no estudo de Leal.(20)
Após a familiarização da respiração diafragmática, os pacientes realizaram três manobras de CVL utilizando um ventilômetro da marca Wright (Ferraris Medical Ltd., Hertford, Inglaterra). As manobras de CVL aconteceram da se-guinte forma: a primeira próxima da CPT até próximo do VR e a segunda partindo do VR até próximo da CPT. O maior valor foi registrado para posterior comparação com aquele que seria aferido durante o exame da MD para verificar se os pacientes realizaram o mesmo esforço respiratório antes e durante a avaliação da MD.
Após a familiarização com a musculatura diafragmática e a realização das manobras de CVL, a avaliação da MD foi realizada por meio da radiografia de tórax em incidência anteroposterior. Para a aquisição da imagem radiográfica, os pacientes foram posicionados na mesa de radioscopia em decúbito dorsal, e foi colocada uma régua de graduação radiopaca sob o tronco desses indivíduos, na direção longitudinal e no sentido craniocaudal, próximo à transição toracoabdominal, para posterior realização da correção da ampliação determinada pela divergência dos raios. As imagens foram registradas no mesmo filme, em inspiração e expiração máximas.
A medida da MD foi determinada por meio do método descrito por Saltiel et al.(21): foi traçada uma linha reta a par-tir do ponto mais alto da hemicúpula diafragmática em expiração até encontrar a hemicúpula diafragmática em inspi-ração por meio da utilização de um paquímetro digital de 150 mm (Messen; Sensor Technology Co.,. Guangdong, China; Figura 1).
 Dispneia
DispneiaA dispneia foi mensurada por meio da escala de dispneia do Medical Research Council modificada,(22) cuja classifi-cação varia de 0 a 4, sendo 4 um valor indicativo de maior grau de dispneia. O paciente escolhia o número que melhor explicasse sua percepção da dispneia.
AFVDA avaliação da AFVD foi realizada com um acelerômetro triaxial DynaPort activity monitor (McRoberts, Haia, Países Baixos). O equipamento consiste em um dispositivo pequeno e leve, acoplado em uma faixa posicionada na cintura do paciente. Esse instrumento é capaz de distinguir atividades como sentar, deitar e caminhar, além de medir o tempo empregado em cada atividade.(23) Os participantes foram monitorados por dois dias consecutivos durante 12 h por dia, com início logo após o despertar. A amostra foi classificada como ativa (tempo caminhando) ou sedentária (tempo sentado e deitado), sendo utilizada para análise a média dos dois dias. Os participantes foram orientados quanto ao posicionamento do dispositivo e receberam um manual com instruções claras e figuras explicativas. Além disso, foram instruídos para que mantivessem suas atividades diárias completamente inalteradas durante a utiliza-ção do dispositivo.
Cálculo amostralPara analisar o poder da amostra de 25 pacientes, foi utilizado o programa estatístico gratuito G*Power, versão 3.1.9.2., sendo realizado o cálculo post hoc.
EstatísticaAs análises estatísticas foram realizadas utilizando-se o pacote estatístico IBM SPSS Statistics, versão 20.0 (IBM Corporation, Armonk, NY, EUA) através de análise descritiva (média e desvio-padrão) e inferencial. Para verificar a normalidade dos dados foi aplicado o teste de Shapiro-Wilk. Conforme a distribuição dos dados, foi utilizado um teste paramétrico ou um não paramétrico. Para verificar a diferença entre os grupos, foi utilizado o teste t independente e o teste U de Mann-Whitney. Para avaliar as correlações entre a MD e as variáveis IMC, relação VEF1/CVF, VEF1, CVF, CI, VVM, PImáx, PEmáx, percepção de dispneia e AFVD, foi utilizado o coeficiente de correlação de Pearson ou de Spearman para as variáveis paramétricas e não paramétricas, respectivamente. A magnitude das correlações foi descrita conforme Dancey e Reidy,(24) que consideram valores de r entre 0,10 e 0,39 como fracos; entre 0,40 e 0,69 como moderados; e entre 0,70 e 1,00 como fortes. Foi adotado o nível de significância de 5% (p < 0,05) para todos os testes.
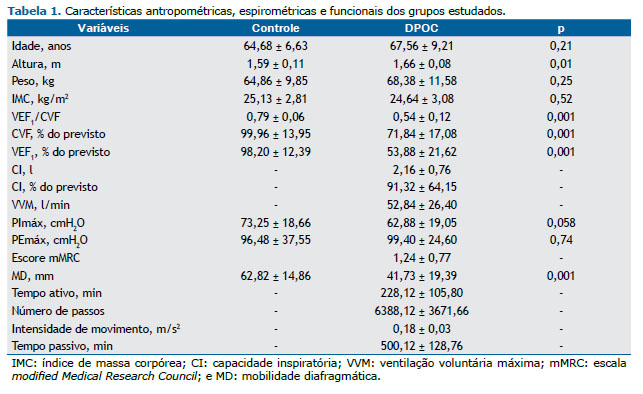
RESULTADOSParticiparam do estudo 25 pacientes com DPOC e 25 indivíduos saudáveis que não diferiram quanto à idade, peso e força muscular respiratória. Embora o grupo controle tenha sido classificado como com sobrepeso e o grupo DPOC como eutrófico,(25) não houve diferença estatisticamente significante entre o IMC dos grupos. Os grupos apresenta-ram diferenças quanto a altura, relação VEF1/CVF, VEF1, CVF e MD. Os resultados dos grupos estão descritos na Tabela 1.
Os coeficientes de determinação da MD com as variáveis estudadas no grupo DPOC estão descritos na Tabela 2. Considerando-se um nível de significância de 5%, foram encontrados os seguintes poderes: 0,96 para VEF1/CVF; 0,95 para VEF1; 0,84 para CVF, 0,99 para CI; 0,99 para VVM; 0,95 para PImáx; e 0,73 para percepção de dispneia. Não foram utilizadas as variáveis PEmáx e AFVD, pois elas não apresentaram correlações com a MD.
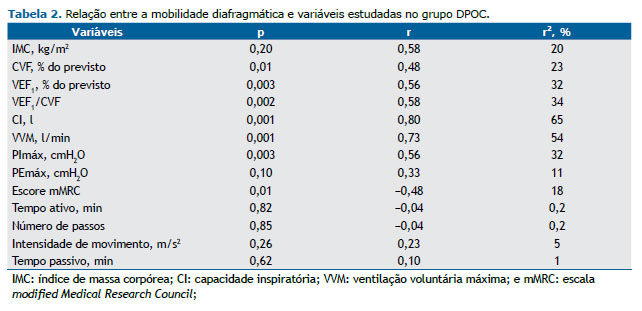
No grupo DPOC houve correlações moderadas da MD com a função pulmonar, a força muscular inspiratória e a percepção de dispneia. Houve também correlações fortes da MD com a VVM e a CI. Já no grupo controle, não foi observada nenhuma correlação entre a MD e as variáveis estudadas no grupo (função pulmonar e força muscular respiratória; Tabela 2).
DISCUSSÃOO presente estudo demonstrou que, em pacientes com DPOC, a MD apresentou uma correlação moderada com o VEF1 e uma forte correlação com a CI, possivelmente porque o aumento da obstrução ao fluxo aéreo, avaliado pelo VEF1, e a hiperinsuflação pulmonar estática, avaliada pela CI, geram um aumento das cargas de trabalho que alte-ram a parede torácica, colocando o músculo diafragma em desvantagem geométrica e mecânica.(26,27) Além disso, a hiperinsuflação pulmonar reduz a capacidade do diafragma de gerar fluxo e pressão,(28) fazendo-o trabalhar de forma encurtada.(29)
A hiperinsuflação pulmonar é uma das principais alterações no paciente com DPOC; contudo, o aprisionamento aéreo é o principal fator limitante da MD nesses pacientes.(3) Em decorrência das mudanças estruturais, ocorre uma remodelação do diafragma, que tende a se retificar e, consequentemente, restringe sua excursão.(30) Essas altera-ções justificam as diferenças na MD e na função pulmonar entre pacientes com DPOC e indivíduos saudáveis, as quais já eram esperadas e já foram relatadas por outros autores.(1-3,29)
Ainda no presente estudo foi encontrada uma forte correlação da MD com a VVM em pacientes com DPOC, de-monstrando que quanto maior a MD do paciente, melhor a sua capacidade de ventilar. Esse resultado está de acordo com o estudo de Kang et al.,(31) que observaram uma significativa correlação da MD com a VVM e sugeriram a possi-bilidade de uma baixa MD estar relacionada com hipercapnia em pacientes com DPOC.
A limitação ventilatória ao esforço em pacientes com DPOC é decorrente da baixa capacidade ventilatória associa-da ao aumento da obstrução pulmonar e, consequentemente, da hiperinsuflação, que se evidencia pela diminuição da CI e pela redução da reserva ventilatória.(32) No presente estudo, que conta com pacientes com grau de obstrução de moderado a grave, a MD apresentou uma correlação moderada com a CI, a qual também explicou 65% da varia-ção da MD, reforçando a influência da hiperinsuflação pulmonar sobre a mecânica diafragmática. No entanto, sabe-se que o aprisionamento aéreo pode ter mais influência sobre a MD do que a própria hiperinsuflação pulmonar.(3)
Apesar de a literatura ter demonstrado correlações da MD com parâmetros como obstrução pulmonar, hiperinsufla-ção(33) e aprisionamento aéreo,(3) Davachi et al.(11) não encontraram uma relação entre a MD e a hiperinsuflação pulmonar, possivelmente porque foram selecionados pacientes com DPOC em estágios mais leves da doença, o que pode ter influenciado essa relação devido ao menor grau de obstrução ao fluxo expiratório, causando menores pre-juízos ao diafragma.
Em nosso estudo foi encontrada uma correlação negativa e moderada da MD com a percepção de dispneia nesses pacientes, indicando que alterações no posicionamento do diafragma dificultam a ventilação, diminuindo a capacida-de respiratória e aumentando a sensação de dispneia.(34) Esses resultados corroboram o estudo de Paulin et al.,(2) que observaram que os pacientes que apresentavam redução da MD possuíam uma maior sensação de dispneia após exercício submáximo.
Apesar de não ter sido encontrada uma correlação entre AFVD e MD nos pacientes com DPOC, sabe-se que, com a progressão da doença, a capacidade de exercitar-se diminui nesses pacientes.(35) Dessa forma, é gerado um círculo vicioso de aumento da dispneia ao realizar suas atividades, levando a inatividade, diminuição de condicionamento físico e maior número de comorbidades e internações.(36) Já é comprovado que a maioria dos pacientes com DPOC gasta mais tempo do seu dia sentado e deitado do que caminhando ou em pé quando comparado com indivíduos idosos saudáveis sedentários(23,37); entretanto a relação entre a MD e a AFVD nesses pacientes ainda não foi encon-trada.
É importante destacar que a avaliação da AFVD por meio de acelerômetros triaxiais reflete quanto o indivíduo é fisicamente ativo ou inativo no seu dia a dia.(38) No entanto, essa avaliação provavelmente depende de diversos fatores que vão além da avaliação da MD, o que poderia explicar a não correlação dessas variáveis. Além disso, a quantidade de pacientes participantes da amostra e o tempo de avaliação de apenas dois dias podem ter sido insufi-cientes para se observar essa relação.
Não encontramos relações entre a MD e o IMC. Kantarci et al.(39) observaram por análise de regressão múltipla que a circunferência abdominal parece ser mais significativa na avaliação da MD do que o IMC, o que sugere que, apesar de ele ser um bom indicador do estado nutricional, o IMC não retrata as diferenças individuais da composição corpó-rea, como a distribuição de gordura abdominal.
Encontramos uma relação entre a PImáx e a MD que pode ser explicada pela desvantagem mecânica em que essa musculatura se encontra devido ao aprisionamento aéreo, o que induz os músculos inspiratórios a trabalharem em uma posição encurtada, dificultando o seu potencial de contração muscular.(30) Kodric et al.(40) mostraram que o treinamento muscular inspiratório em pacientes com disfunção diafragmática após cirurgia cardíaca foi capaz de melhorar a MD, demonstrando uma possível relação entre a melhora da PImáx e a MD.
Nossos resultados sugerem que MD é um parâmetro que pode fornecer informações sobre a mecânica respiratória de pacientes com DPOC e que apresenta relação com alguns parâmetros pulmonares (VEF1, relação VEF1/CVF, CVF, CI e VVM) e funcionais do paciente. Todavia, ainda nota-se a necessidade de estudos com um maior número de pacientes visando analisar a relação da MD sobre a AFVD.
Uma possível limitação do estudo foi que, na amostra estudada, não foi avaliado nenhum paciente no estágio I. No entanto, tal problema é comum na literatura, já que pacientes nesse estágio são normalmente assintomáticos e, consequentemente, não procuram auxílio médico. Sendo assim, não se podem extrapolar os resultados aqui obtidos para todos os graus de comprometimento da DPOC. Além disso, a postura adotada durante a avaliação da MD talvez possa influenciar o resultado obtido; portanto, sugere-se a comparação da MD na posição ortostática e em decúbito dorsal em estudos futuros.
Sumarizando, a MD está relacionada tanto com a obstrução das vias aéreas quanto com a hiperinsuflação pulmo-nar em pacientes com DPOC, assim como com a sua capacidade ventilatória e percepção de dispneia. A MD não demonstrou relações com a AFVD dos pacientes com DPOC.
REFERÊNCIAS1. Iwasawa T, Kagei S, Gotoh T, Yoshiike Y, Matsushita K, Kurihara H, et al. Magnetic resonance analysis of abnormal diaphragmatic motion in patients with emphysema. Eur Respir J. 2002;19(2):225-31. https://doi.org/10.1183/09031936.02.00044602
2. Paulin E, Yamaguti WP, Chammas MC, Shibao S, Stelmach R, Cukier A, et al. Influence of diaphragmatic mobility on exercise tolerance and dyspnea in patients with COPD. Respir Med. 2007;101(10): 2113-8. https://doi.org/10.1016/j.rmed.2007.05.024
3. Dos Santos Yamaguti WP, Paulin E, Shibao S, Chammas MC, Salge JM, Ribeiro M, et al. Air trapping: The major factor limiting diaphragm mobility in chronic obstructive pulmonary disease patients. Respirology. 2008;13(1):138-44. https://doi.org/10.1111/j.1440-1843.2007.01194.x
4. Yamaguti WP, Claudino RC, Neto AP, Chammas MC, Gomes AC, Salge JM, et al. Diaphragmatic breathing training program improves abdominal motion during natural breathing in patients with chronic obstructive pulmonary disease: a randomized controlled trial. Arch Physic Med Rehab. 2012;93(4):571-7. https://doi.org/10.1016/j.apmr.2011.11.026
5. Sociedade Brasileira de Pneumologia e Tisiologia. II Consenso Brasileiro sobre Doença Pulmonar Obstrutiva Crônica - DPOC - 2004. J Bras Pneumol. 2004;30(Suppl 5):S1-S42.
6. Watz H, Waschki B, Boehme C, Claussen M, Meyer T, Magnussen H. Extrapulmonary effects of chronic obstructive pulmonary disease on physical activity: a cross-sectional study. Am J Respir Crit Care Med. 2008;177(7):743-51. https://doi.org/10.1164/rccm.200707-1011OC
7. Bossenbroek L, de Greef MH, Wempe JB, Krijnen WP, Ten Hacken NH. Daily physical activity in patients with chronic obstructive pulmonary disease: a systematic review. COPD. 2011;8(4):306-19. https://doi.org/10.3109/15412555.2011.578601
8. Rabe KF, Hurd S, Anzueto A, Barnes PJ, Buist SA, Calverley P, et al. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: GOLD executive summary. Am J Respir Crit Care Med. 2007;176(6):532-55 https://doi.org/10.1164/rccm.200703-456SO
9. Global Initiative for Chronic Obstructive Lung Disease [homepage on the Internet]. Bethesda: Global Initiative for Chronic Obstructive Lung Disease. [cited 2016 Jan 10]. Global strategy for the diagnosis, management, and prevention of COPD - 2015. Available from: http://goldcopd.org/global-strategy-diagnosis-management-prevention-copd-2015/
10. Skumlien S, Hagelund T, Bjørtuft O, Ryg MS. A field test of functional status as performance of activities of daily living in COPD patients. Respir Med. 2006;100(2):316-23. https://doi.org/10.1016/j.rmed.2005.04.022
11. Davachi B, Lari SM, Attaran D, Tohidi M, Ghofraniha L, Amini M, et al. The relationship between diaphragmatic movements in sonographic assessment and disease severity in patients with stable chronic obstructive pulmonary disease (COPD). J Cardiothorac Med. 2014;2(3):187-92.
12. Yamaguti WP, Paulin E, Salge JM, Chammas MC, Cukier A, Carvalho CR. Diaphragmatic dysfunction and mortality in patients with COPD. J Bras Pneumol. 2009;35(12):1174-81. https://doi.org/10.1590/S1806-37132009001200003
13. Scott S, Fuld JP, Carter R, McEntegart M, MacFarlane NG. Diaphragm ultrasonography as an alternative to whole-body plethysmography in pulmonary function testing. J Ultrasound Med. 2006;25(2):225-32.
14. Decramer M, Jiang TX, Demedts M. Effects of acute hyperinflation on chest wall mechanics in dogs. J Appl Physiol (1985). 1987;63(4):1493-8.
15. Sinderby C, Spahija J, Beck J, Kaminski D, Yan S, Comtois N, et al. Diaphragm activation during exercise in chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2001;163(7):1637-41. https://doi.org/10.1164/ajrccm.163.7.2007033
16. Miller MR, Hankinson J, Brusasco V, Burgos F, Casaburi R, Coates A, et al. Standardisation of spirometry. Eur Respir J. 2005;26(2):319-38. https://doi.org/10.1183/09031936.05.00034805
17. Pereira CA, Sato T, Rodrigues SC. New reference values for forced spirometry in white adults in Brazil. J Bras Pneumol. 2007;33(4):397-406. https://doi.org/10.1590/S1806-37132007000400008
18. Souza RB. Pressões respiratórias estáticas máximas. In: Sociedade Brasileira de Pneumologia e Tisiologia. Diretrizes para testes de função pulmonar. J Pneumol. 2002;28(Suppl 3):S155-S165.
19. Neder J, Andreoni S, Lerario M, Nery L. Reference values for lung function tests. II. Maximal respiratory pressures and voluntary ventilation. Braz J Med Biol Res. 1999;32(6):719-27. https://doi.org/10.1590/S0100-879X1999000600007
20. Leal BCE. Validade e confiabilidade da fluoroscopia por radiografia digital: uma nova forma de avaliar a mobilidade diafragmática [dissertation]. Florianópolis: Universidade do Estado de Santa Catarina; 2014.
21. Saltiel RV, Grams ST, Pedrini A, Paulin E. High reliability of measure of diaphragmatic mobility by radiographic method in healthy individuals. Braz J Phys Ther. 2013;17(2):128-36. https://doi.org/10.1590/S1413-35552012005000076
22. Hajiro T, Nishimura K, Tsukino M, Ikeda A, Koyama H, Izumi T. Analysis of clinical methods used to evaluate dyspnea in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 1998;158(4):1185-9. https://doi.org/10.1164/ajrccm.158.4.9802091
23. Pitta F, Troosters T, Spruit MA, Probst VS, Decramer M, Gosselink R. Characteristics of physical activities in daily life in chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2005;171(9):972-7. https://doi.org/10.1164/rccm.200407-855OC
24. Dancey C, Reidy J. Estatística sem matemática para psicologia: usando SPSS para Windows. 5th ed. Porto Alegre: Artmed; 2006.
25. World Health Organization. Obesity: preventing and managing the global epidemic. Report of a World Health Organization Consultation. Geneva: World Health Organization; 2000. p. 284-56.
26. De Troyer A. Effect of hyperinflation on the diaphragm. Eur Respir J. 1997;10(3):708-13.
27. Poole DC, Sexton WL, Farkas GA, Powers SK, Reid MB. Diaphragm structure and function in health and disease. Med Sci Sports Exerc. 1997;29(6):738-54. https://doi.org/10.1097/00005768-199706000-00003
28. McKenzie DK, Butler JE, Gandevia SC. Respiratory muscle function and activation in chronic obstructive pulmonary disease. J Appl Physiol (1985). 2009;107(2):621-9. https://doi.org/10.1152/japplphysiol.00163.2009
29. Unal O, Arslan H, Uzun K, Ozbay B, Sakarya ME. Evaluation of diaphragmatic movement with MR fluoroscopy in chronic obstructive pulmonary disease. Clin Imaging. 2000;24(6):347-50. https://doi.org/10.1016/S0899-7071(00)00245-X
30. Reid WD, Samrai B. Respiratory muscle training for patients with chronic obstructive pulmonary disease. Phys Ther. 1995;75(11):996-1005.
31. Kang HW, Kim TO, Lee BR, Yu JY, Chi SY, Ban HJ, et al. Influence of diaphragmatic mobility on hypercapnia in patients with chronic obstructive pulmonary disease. J Korean Med Sci. 2011;26(9):1209-13. https://doi.org/10.3346/jkms.2011.26.9.1209
32. Freitas CG, Pereira CA, Viegas CA. Inspiratory capacity, exercise limitation, markers of severity, and prognostic factors in chronic obstructive pulmonary disease. J Bras Pneumol. 2007;33(4):389-96. https://doi.org/10.1590/S1806-37132007000400007
33. Iwasawa T, Takahashi H, Ogura T, Asakura A, Gotoh T, Shibata H, et al. Influence of the distribution of emphysema on diaphragmatic motion in patients with chronic obstructive pulmonary disease. Jpn J Radiol. 2011;29(4):256-64. https://doi.org/10.1007/s11604-010-0552-8
34. McConnell AK, Romer LM. Dyspnoea in health and obstructive pulmonary disease: the role of respiratory muscle function and training. Sports Med. 2004;34(2):117-32. https://doi.org/10.2165/00007256-200434020-00005
35. Park SK, Meldrum CA, Larson JL. Subgroup analysis of symptoms and their effect on functioning, exercise capacity, and physical activity in patients with severe chronic obstructive pulmonary disease. Heart Lung. 2013;42(6):465-72. https://doi.org/10.1016/j.hrtlng.2013.08.008
36. Esteban C, Quintana JM, Aburto M, Moraza J, Egurrola M, Pérez-Izquierdo J, et al. Impact of changes in physical activity on health-related quality of life among patients with COPD. Eur Respir J. 2010;36(2):292-300. https://doi.org/10.1183/09031936.00021409
37. Hernandes NA, Teixeira Dde C, Probst VS, Brunetto AF, Ramos EM, Pitta F. Profile of the level of physical activity in the daily lives of patients with COPD in Brazil. J Bras Pneumol. 2009;35(10):949-56.
38. Brandes M, Rosenbaum D. Correlations between the step activity monitor and the DynaPort ADL-monitor. Clin Biomech (Bristol, Avon). 2004;19(1):91-4. https://doi.org/10.1016/j.clinbiomech.2003.08.001
39. Kantarci F, Mihmanli I, Demirel MK, Harmanci K, Akman C, Aydogan F, et al. Normal diaphragmatic motion and the effects of body composition: determination with M-mode sonography. J Ultrasound Med. 2004;23(2):255-60.
40. Kodric M, Trevisan R, Torregiani C, Cifaldi R, Longo C, Cantarutti F, et al. Inspiratory muscle training for diaphragm dysfunction after cardiac surgery. J Thorac Cardiovasc Surg. 2013;145(3):819-23. https://doi.org/10.1016/j.jtcvs.2012.07.087






