ABSTRACT
Objective: Impaired respiratory mechanics and gas exchange may contribute to sleep disturbance in patients with COPD. We aimed to assess putative associations of different domains of lung function (airflow limitation, lung volumes, and gas exchange efficiency) with polysomnography (PSG)-derived parameters of sleep quality and architecture in COPD. Methods: We retrospectively assessed data from COPD 181 patients = 40 years of age who underwent spirometry, plethysmography, and overnight PSG. Univariate and multivariate linear regression models predicted sleep efficiency (total sleep time/total recording time) and other PSG-derived parameters that reflect sleep quality. Results: The severity of COPD was widely distributed in the sample (post-bronchodilator FEV1 ranging from 25% to 128% of predicted): mild COPD (40.3%), moderate COPD (43.1%), and severe-very severe COPD (16.6%). PSG unveiled a high proportion of obstructive sleep apnea (64.1%) and significant nocturnal desaturation (mean pulse oximetry nadir = 82.2% ± 6.9%). After controlling for age, sex, BMI, apnea-hypopnea index, nocturnal desaturation, comorbidities, and psychotropic drug prescription, FEV1/FVC was associated with sleep efficiency (ß = 25.366; R2 = 14%; p < 0.001), whereas DLCO predicted sleep onset latency (ß = -0.314; R2 = 13%; p < 0.001) and rapid eye movement sleep time/total sleep time in % (ß = 0.085; R2 = 15%; p = 0.001). Conclusions: Pulmonary function variables reflecting severity of airflow and gas exchange impairment, adjusted for some potential confounders, were weakly related to PSG outcomes in COPD patients. The direct contribution of the pathophysiological hallmarks of COPD to objectively measured parameters of sleep quality seems to be less important than it was previously assumed.
Keywords:
Pulmonary disease, chronic obstructive; Respiratory function tests; Sleep; Sleep apnea, obstructive; Comorbidity.
RESUMO
Objetivo: O comprometimento da mecânica respiratória e das trocas gasosas pode contribuir para distúrbios do sono em pacientes com DPOC. Objetivamos avaliar associações putativas de diferentes domínios da função pulmonar (limitação do fluxo aéreo, volumes pulmonares e eficiência das trocas gasosas) com parâmetros da qualidade e arquitetura do sono na DPOC derivados da polissonografia (PSG). Métodos: Avaliamos retrospectivamente dados de 181 pacientes com DPOC e idade ≥ 40 anos que foram submetidos a espirometria, pletismografia e PSG de noite inteira. Modelos de regressão linear univariada e multivariada foram utilizados para avaliar a associação de variáveis de função pulmonar com a eficiência do sono (tempo total de sono/tempo total de registro) e outros parâmetros derivados da PSG que refletem a qualidade do sono. Resultados: A gravidade da DPOC foi bem distribuída na amostra (VEF1 pós-broncodilatador variando de 25% a 128% do previsto): DPOC leve (40,3%), DPOC moderada (43,1%) e DPOC grave-muito grave (16,6%). A PSG revelou uma alta frequência de apneia obstrutiva do sono (64,1%) e dessaturação noturna significativa (nadir médio da oximetria de pulso = 82,2% ± 6,9%). Após controle para idade, sexo, IMC, índice de apneia-hipopneia, dessaturação noturna, comorbidades e prescrição de psicotrópicos, a relação VEF1/CVF apresentou associação com a eficiência do sono (β = 25,366; R2 = 14%; p < 0,001), enquanto a DLCO previu a latência para o início do sono (β = −0,314; R2 = 13%; p < 0,001) e o tempo de sono rapid eye movement/tempo total de sono em % (β = 0,085; R2 = 15%; p = 0,001). Conclusões: As variáveis de função pulmonar que refletem a gravidade do comprometimento do fluxo aéreo e das trocas gasosas, ajustadas para alguns potenciais fatores de confusão, apresentaram fraca relação com os resultados da PSG nos pacientes com DPOC. A contribuição direta das características fisiopatológicas da DPOC para os parâmetros da qualidade do sono medidos objetivamente parece ser menos importante do que se supunha anteriormente.
Palavras-chave:
Doença pulmonar obstrutiva crônica; Testes de função respiratória; Sono; Apneia obstrutiva do sono; Comorbidade.
INTRODUÇÃO A DPOC pode potencializar os complexos efeitos do sono sobre o sistema respiratório, incluindo alterações no controle respiratório central, na resistência das vias aéreas, nas trocas gasosas e na contratilidade dos músculos respiratórios.
(1) Dessa forma, pacientes com DPOC frequentemente relatam comprometimento do sono,
(2-4) o qual foi classificado como o terceiro sintoma mais comum, depois da dispneia e da fadiga.
(2) Esses pacientes também relatam a manhã como o pior momento do dia em relação a níveis de energia e disposição para realizar atividades da vida diária.
(5) De fato, baixa eficiência do sono,
(6,7) alteração da arquitetura do sono
(3) e dificuldade para iniciar e manter o sono
(3,4,8) já foram confirmados por meio da polissonografia (PSG) de noite inteira nessa população de pacientes.
Entretanto, os mecanismos que levam ao comprometimento do sono na DPOC ainda são controversos.
(9,10) A alteração da mecânica respiratória e anormalidades nas trocas gasosas
(11) podem tornar os pacientes mais suscetíveis a hipoventilação e hipoxemia noturnas. Estudos anteriores demonstraram que a obstrução do fluxo aéreo
(7) e a hiperinsuflação pulmonar
(7,12) apresentaram correlação com pior qualidade do sono, enquanto a dessaturação noturna de O2 pode alterar a arquitetura do sono.
(13) A diminuição do comando neural respiratório para os músculos respiratórios durante o sono
(14) também pode contribuir para a hipoventilação noturna e distúrbios do sono. Além disso, a qualidade do sono também pode ser negativamente afetada por uma infinidade de fatores que são comuns em pacientes com DPOC, como senescência, obesidade, comorbidades cardiovasculares/metabólicas
(15) e polifarmácia.
(10) Essas características são ainda mais prevalentes em pacientes com maior comprometimento da função pulmonar.
(15) Sendo assim, levantamos a hipótese de que o(s) efeito(s) das anormalidades da função pulmonar em repouso sobre o comprometimento da qualidade do sono
(7,12,13) poderia(m) ser influenciado(s) por características como obesidade, dessaturação noturna, comorbidades, prescrição de psicotrópicos e/ou consumo de álcool, as quais são frequentemente observadas em idosos com DPOC.
Nosso objetivo, portanto, foi avaliar — após um ajuste para os fatores de confusão mencionados acima — associações de diferentes variáveis da função pulmonar (limitação do fluxo aéreo, volumes pulmonares e eficiência das trocas gasosas) com parâmetros da qualidade e arquitetura do sono mensuradas por polissonografia (PSG) em pacientes com DPOC.
MÉTODOS Desenho e população do estudo Trata-se de um estudo transversal com coleta retrospectiva de dados. Utilizando critérios pré-especificados, foram revisados todos os pacientes consecutivos com idade ≥ 40 anos que foram encaminhados aos Laboratórios Clínicos dos Hospitais-Escola afiliados à Queen’s University (Kingston General Hospital e Hotel Dieu Hospital, ambos localizados na cidade de Kingston, Canadá) para espirometria com avaliação pós-broncodilatador, pletismografia de corpo inteiro, DLCO e PSG de noite inteira entre 2008 e 2016 (Figura 1). Esses exames foram solicitados a critério do médico assistente para avaliação de queixas respiratórias (função pulmonar) e de queixas relacionadas ao sono (PSG). No caso de medições seriadas da função pulmonar, a última avaliação foi registrada para análise. Os seguintes dados foram obtidos dos laudos de PSG: idade, sexo, IMC, tabagismo (ex-fumante/fumante atual vs. nunca fumou), diagnóstico principal, comorbidades, consumo de álcool (no dia do exame) e prescrição de medicamentos.
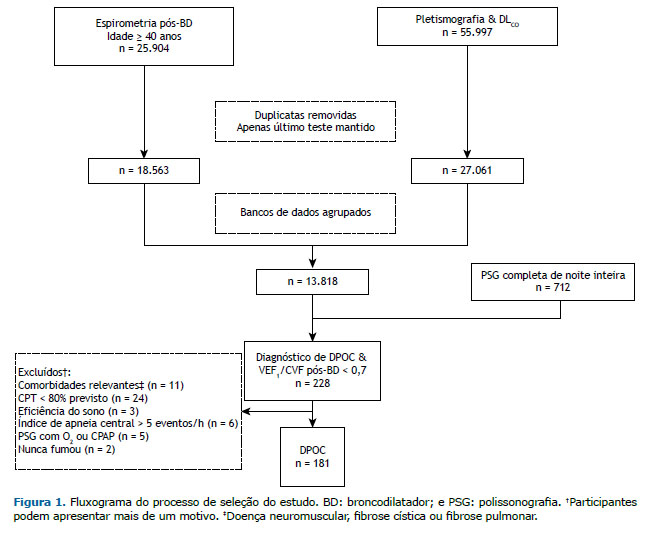
Os participantes foram incluídos com base no diagnóstico ou suspeita de DPOC pelo médico assistente, VEF1/CVF pós-broncodilatador (salbutamol, 400 µg) < 0,70 e histórico de tabagismo atual ou pregresso. Os critérios de exclusão incluíram condições que poderiam afetar a qualidade do sono (doença neuromuscular, acidente vascular cerebral prévio com sequelas neurológicas ou câncer ativo); outra doença respiratória crônica (bronquiectasia, doença pulmonar intersticial, CPT < 80% dos valores previstos); curto período de sono durante a PSG (tempo total de sono [TTS]/tempo total de registro [eficiência do sono] < 20%); índice de apneia central > 5 eventos/h; e/ou uso noturno de CPAP ou suplementação noturna de oxigênio.
Os indivíduos foram identificados por números sem a identificação dos nomes. O estudo (no. 6020749) foi aprovado pelo Conselho de Ética em Pesquisa das Ciências da Saúde da Queen’s University e Hospitais-Escola afiliados (FWA no. 00004184; IRB no. 00001173). O consentimento informado foi dispensado pelo comitê de pesquisa institucional em razão do desenho retrospectivo do estudo e da garantia de anonimato de todos os dados individuais incluídos no estudo.
Procedimentos A espirometria (incluindo capacidade inspiratória [CI]), a pletismografia corporal e as medições da DLCO foram realizadas em equipamentos de teste automatizados (V6200 Autobox; SensorMedics, Yorba Linda, CA, EUA), no Laboratório de Função Pulmonar do Hotel Dieu Hospital, de acordo com padrões internacionais (American Thoracic Society/European Respiratory Society).
As medições da PSG padrão foram coletadas no Laboratório do Sono do Kingston General Hospital. As gravações contínuas utilizando o sistema digital Sandman Elite SD 32+ (Embla; Mallinckrodt/Nellcor Puritan Bennett [Melville] Ltd, Mansfield, MA, EUA) incluíram quatro canais de eletroencefalografia (C4A1, C3A2, O2A1 e O1A2); dois canais de eletro-oculograma (ROCA1 e LOCA2); eletromiografia submentoniana; eletromiografia tibial anterior bilateral; eletrocardiografia; cintas respiratórias torácica e abdominal; pressão nasal via cânula nasal; oxímetro de pulso de dedo (SpO2); e um sensor de ronco por vibração. O sono foi estagiado e os episódios de apneias e hipopneias obstrutivas definidos segundo critérios estabelecidos.
(16) Apneias foram definidas como centrais se houvesse falta de esforço respiratório durante o período de ausência do fluxo aéreo. A sonolência diurna foi avaliada com a Escala de Sonolência de Epworth. Uma pontuação igual ou superior a 10 pontos foi considerada como presença de sonolência diurna excessiva. Apneia obstrutiva do sono (AOS) foi definida como um índice de apneia-hipopneia (IAH) ≥ 5 eventos/h associado à sonolência diurna excessiva ou um IAH ≥ 15 eventos/h independentemente dos sintomas coexistentes.
(17) Valores de eficiência do sono < 85% foram definidos como reduzidos.
(18,19) Os testes de função pulmonar e a PSG foram realizados rotineiramente apenas se o indivíduo estivesse clinicamente estável nas últimas quatro semanas.
Análise estatística As análises estatísticas foram realizadas com o programa IBM SPSS Statistics, versão 24.0 (IBM Corporation, Armonk, NY, EUA). Os valores são relatados como médias e desvios-padrão, a menos que especificado de outra forma. Um tamanho amostral estimado de 139 indivíduos foi necessário para detectar associações entre variáveis contínuas dependentes (parâmetros do sono derivados da PSG) e 15 preditores, considerando-se um nível de significância de p < 0,05, um poder estatístico desejado de 0,8 e um tamanho do efeito (f2) de 0,15.
(20) As análises de regressão linear univariada foram inicialmente realizadas para avaliar as associações das variáveis de função pulmonar em repouso (VEF1/CVF, CI/CPT, VR/CPT e DLCO em % dos valores previstos) e dos potenciais fatores de confusão (idade, sexo, IMC, IAH, parâmetros de dessaturação noturna, comorbidades, prescrição de psicotrópicos e ingestão de álcool) com os parâmetros da PSG que refletem a qualidade e arquitetura do sono.
(21-24) Subsequentemente, foram realizadas análises multivariadas de primeira ordem (método backward stepwise), incluindo variáveis de função pulmonar e da PSG (IAH e parâmetros de dessaturação noturna), bem como variáveis antropométricas e demográficas, que apresentaram p ≤ 0,10 nos modelos univariados. Se os parâmetros de função pulmonar permaneceram como preditores independentes de desempenho do sono nos modelos de primeira ordem, essas análises multivariadas foram adicionalmente ajustadas para presença de comorbidades, prescrição de psicotrópicos
(25) e ingestão de álcool no dia da PSG
(26) se p fora ≤ 0,10 nos modelos univariados (modelos finais). O nível de significância adotado para a manutenção de uma variável no modelo multivariado foi de p ≤ 0,05.
RESULTADOS A gravidade da DPOC foi bem distribuída entre os 181 pacientes incluídos (VEF1 pós-broncodilatador variando de 25% a 128% do previsto): DPOC leve, em 73 pacientes (40,3%); DPOC moderada, em 78 (43,1%); e DPOC grave-muito grave, em 30 (16,6%). Como esperado, esses participantes apresentaram comprometimento da mecânica ventilatória e das trocas gasosas (DLCO) em repouso de acordo com os valores previstos (Tabela 1).
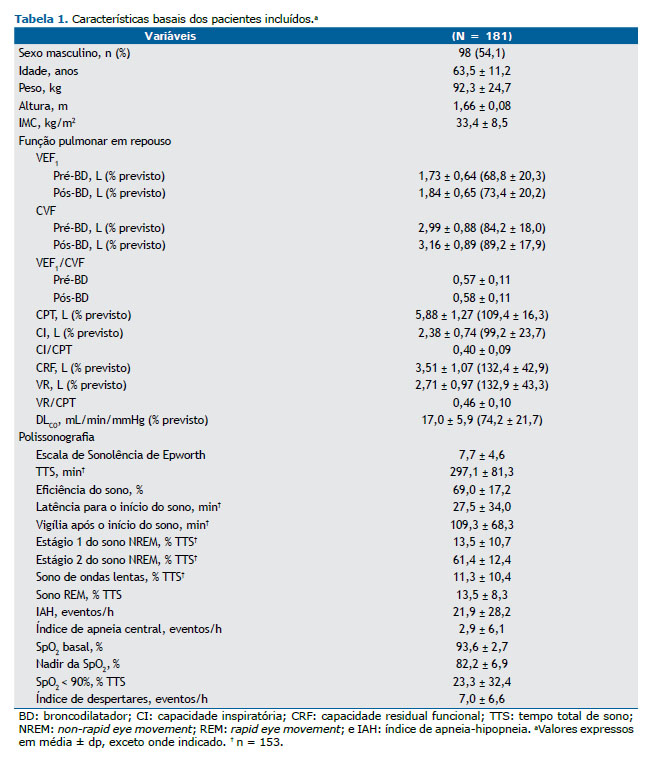
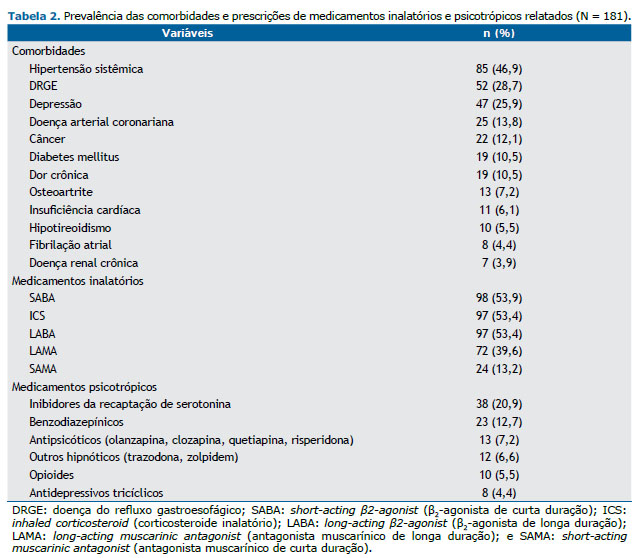
Os indivíduos incluídos no estudo apresentaram redução da eficiência média do sono em comparação aos controles históricos, sendo que 144 (79,5%) apresentaram valores reduzidos (< 85%). A PSG também revelou uma alta frequência de AOS (116 indivíduos; 64,1%) e dessaturação noturna significativa (Tabela 1). A presença de AOS diagnosticada por PSG apresentou relação apenas com o sono de ondas lentas, expresso em % do TTS (β = −4,212; R2 = 4%; p = 0,015). Como esperado, foi observada uma alta prevalência de comorbidades e de uso de psicotrópicos (Tabela 2). Dos 157 indivíduos da amostra, 22 (14,0%) relataram consumo de álcool no dia da PSG.
As análises de regressão linear univariada revelaram que as medidas de função pulmonar em repouso selecionadas apresentaram fraca correlação com os parâmetros derivados da PSG que refletem a qualidade e arquitetura do sono (Tabela 3). Nas análises multivariadas, os parâmetros de função pulmonar que permaneceram como preditores independentes de eficiência do sono, latência para o início do sono e sono rapid eye movement (REM; em % do TTS) foram VEF1/CVF, DLCO e DLCO, respectivamente. Esses modelos foram posteriormente ajustados para presença de comorbidades, prescrição de psicotrópicos e consumo de álcool quando essas variáveis se mostraram relacionadas aos parâmetros da qualidade do sono nas análises univariadas (dados não apresentados). Os modelos de regressão multivariada resultantes mostrando os preditores independentes finais são apresentados na Tabela 4.
DISCUSSÃO O principal achado observado foi que, após controle para idade, sexo, IAH, dessaturação noturna, comorbidades, prescrição de psicotrópicos e consumo de álcool, os parâmetros de função pulmonar em repouso apresentaram fraca relação com a qualidade e arquitetura do sono na DPOC: menor relação VEF1/CVF apresentou associação com menor eficiência do sono, enquanto menor DLCO apresentou associação com maior latência para o início do sono e menor % de sono REM.
A avaliação da qualidade do sono por meio da PSG é comumente encontrada em DPOC.
(3,6-8,12,27) Os parâmetros da PSG que de fato apresentam correlação com as medidas subjetivas da qualidade do sono, no entanto, são controversos. Foram utilizadas variáveis obtidas da PSG que demonstraram estar relacionadas à qualidade subjetiva do sono avaliada por meio de inventários de autorrelato retrospectivo ou por meio de escalas ordinais incluídas em diários prospectivos do sono. A eficiência do sono e o TTS demonstraram correlação significativa com a qualidade subjetiva do sono em um estudo de comunidade incluindo mais de mil adultos idosos, independentemente do sexo.
(21) A porcentagem de estágios de sono de ondas lentas e/ou REM
(22-24) e a latência para o início do sono
(24) mostraram ser bons preditores de satisfação subjetiva do sono em estudos anteriores. Embora várias relações fracas tenham sido observadas nas regressões univariadas, poucas variáveis de função pulmonar permaneceram nos modelos multivariados apresentando baixos coeficientes de determinação para prever eficiência do sono, latência para inicio do sono e % de sono REM. Isso significa que apenas uma pequena proporção da variância dos desfechos puderam ser previstos a partir das variáveis independentes.
Estudos anteriores também não conseguiram encontrar associações significativas e/ou robustas entre variáveis espirométricas e a eficiência do sono na DPOC.
(6,27) No entanto, há muito tempo se reconhece que, em razão da complexidade da DPOC, é aconselhável levar em consideração medidas fisiológicas além do VEF1.
(28) De fato, os índices de hiperinsuflação e aprisionamento aéreo provaram ser mais úteis do que o VEF1 na predição dos sintomas cardinais da doença, como dispneia e intolerância ao exercício,
(29) e também da sobrevida.
(30) Em estudos anteriores, a relação CI/CPT
(12) e a extensão da zona de aposição do diafragma
(7) apresentaram associação com a eficiência do sono. No presente estudo, no entanto, o qual foi ajustado para controle dos fatores de confusão, as relações significativas do aprisionamento aéreo e da hiperinsuflação pulmonar com a eficiência do sono observadas nas regressões univariadas não se mantiveram nas análises multivariadas. É possível, portanto, que o comprometimento da mecânica respiratória e o aumento do trabalho respiratório
(11) tenham contribuído apenas com uma pequena fração para a redução da eficiência o sono. De fato, recentemente mostramos que uma dose noturna de formoterol/aclidínio, em comparação ao placebo, melhorou a mecânica respiratória e o drive neural inspiratório durante a noite, mas não foi encontrado nenhum efeito positivo sobre os resultados da PSG (incluindo a eficiência do sono).
(31) Menor relação VEF1/CVF reflete obstrução mais grave do fluxo aéreo, possivelmente resultando em aumento dos sintomas durante a noite (dispneia, tosse e catarro) e levando a despertares frequentes ou dificuldade para o início do sono.
(3,4,32) A DLCO, por sua vez, persistiu como a única variável de função pulmonar independentemente relacionada à latência para o início do sono e à % de sono REM. Há relatos de que DLCO reduzida apresenta associação com o aumento dos sintomas mesmo em fumantes sem DPOC e em pacientes com doença leve a moderada.
(33) Consequentemente, a DLCO pode também apresentar relação com as alterações do sono devido à maior carga de sintomas respiratórios durante a noite, como tosse e dispneia noturna. Em consonância com essa premissa, Chang et al.
(32) constataram que a gravidade dos sintomas da DPOC (particularmente a tosse produtiva), avaliada por meio do COPD Assessment Test, foi um fator independente para má qualidade do sono. Recentemente, Lehmann et al.
(34) constataram que o uso de dois broncodilatadores (indacaterol/glicopirrônio) melhorou a qualidade subjetiva do sono, a função pulmonar e os sintomas diários. Ainda é preciso investigar qual desses fatores foi o responsável pela melhora da qualidade do sono. Do ponto de vista fisiológico, a DLCO é um marcador de destruição da membrana alveolocapilar desde os estágios iniciais da DPOC.
(35) DLCO baixa, portanto, reflete comprometimento da função vascular, a qual foi associada com piora subjetiva da qualidade do sono e menor % de sono REM.
(36) Curiosamente, o sono REM é parcialmente facilitado pelo óxido nítrico,
(37) substância sintetizada continuamente pelas células endoteliais para a manutenção da homeostase vascular. Mais pesquisas são necessárias para explorar a relação entre função endotelial/vias mediadas pelo óxido nítrico e o sono REM na DPOC.
A detecção e o manejo dos distúrbios do sono parecem relevantes para a redução dos sintomas da DPOC.
(9) Embora em pequena magnitude, os parâmetros de função pulmonar que refletem a gravidade da limitação do fluxo aéreo e o comprometimento das trocas gasosas realmente apresentaram relação com a qualidade e arquitetura do sono na DPOC. Parece razoável considerar essas anormalidades funcionais em conjunto com outros sinais clínicos da doença (sibilância noturna, tosse e catarro), fatores psicológicos relacionados à DPOC e a polifarmácia a fim de estimar a probabilidade de má qualidade do sono em pacientes individuais.
(9) Surpreendentemente, apesar da alta prevalência de AOS (64,1%) nesta amostra de participantes predominantemente obesos, a presença de AOS, bem como a magnitude do sobrepeso (IMC) e do IAH, não interferiu nas relações observadas entre a função pulmonar e a qualidade do sono.
As principais limitações do presente estudo estão relacionadas a seu desenho transversal e natureza retrospectiva. O primeiro impede fortes inferências de causa e efeito. Embora as informações clínicas tenham sido cuidadosamente obtidas na rotina institucional no dia da PSG, alguns potenciais fatores de confusão clínicos adicionais ainda podem ter passado desapercebidos. A ansiedade e a depressão são altamente prevalentes
(38) e apresentam associação com distúrbios do sono na DPOC
(39): a falta de avaliação desses distúrbios por meio de ferramentas objetivas e validadas pode ter influenciado nossos resultados. Além disso, a duração da DPOC, a capacidade de exercício, o histórico de exacerbações, os sintomas respiratórios noturnos e do início da manhã, a adesão e duração do uso dos psicotrópicos prescritos, a duração do consumo de álcool e o tabagismo no dia da PSG não foram avaliados, restringindo a possibilidade de ajuste desses fatores nos modelos multivariados. Embora nossa amostra represente a maior série até o momento na qual a qualidade do sono foi medido objetivamente por meio da PSG de noite inteira e correlacionado com resultados de testes pulmonares básicos e avançados, não podemos descartar que, se esses potenciais fatores de confusão adicionais tivessem sido controlados, relação(ões) mais fracas poderiam ter sido encontradas.
Em conclusão, as variáveis de função pulmonar selecionadas que refletem a gravidade da limitação do fluxo aéreo e a eficiência das trocas gasosas, ajustadas para alguns potenciais fatores de confusão, apresentaram fraca relação com os resultados da PSG nos pacientes com DPOC. A pequena relação direta dessas características fisiopatológicas da DPOC com a qualidade do sono medida objetivamente por PSG ressalta a complexa patogênese dos distúrbios do sono nessa população de pacientes.
CONTRIBUIÇÕES DOS AUTORES RDM e DCB: desenho do estudo, coleta e análise dos dados e redação do manuscrito. ND, HD e AFE: coleta e interpretação dos dados. MF, DEO, SF e JAN: desenho do estudo, interpretação dos dados e revisão do manuscrito. Todos os autores aprovaram a versão final do manuscrito.
REFERÊNCIAS
- McNicholas WT. Impact of sleep in COPD. Chest. 2000;117(2 Suppl):48S-53S. https://doi.org/10.1378/chest.117.2_suppl.48S
- Kinsman RA, Yaroush RA, Fernandez E, Dirks JF, Schocket M, Fukuhara J. Symptoms and experiences in chronic bronchitis and emphysema. Chest. 1983;83(5):755-761. https://doi.org/10.1378/chest.83.5.755
- Cormick W, Olson LG, Hensley MJ, Saunders NA. Nocturnal hypoxaemia and quality of sleep in patients with chronic obstructive lung disease. Thorax. 1986;41(11):846-854. https://doi.org/10.1136/thx.41.11.846
- Bellia V, Catalano F, Scichilone N, Incalzi RA, Spatafora M, Vergani C, et al. Sleep disorders in the elderly with and without chronic airflow obstruction: the SARA study. Sleep. 2003;26(3):318-323. https://doi.org/10.1093/sleep/26.3.318
- Kessler R, Partridge MR, Miravitlles M, Cazzola M, Vogelmeier C, Leynaud D, et al. Symptom variability in patients with severe COPD: a pan-European cross-sectional study. Eur Respir J. 2011;37(2):264-272. https://doi.org/10.1183/09031936.00051110
- Valipour A, Lavie P, Lothaller H, Mikulic I, Burghuber OC. Sleep profile and symptoms of sleep disorders in patients with stable mild to moderate chronic obstructive pulmonary disease. Sleep Med. 2011;12(4):367-372. https://doi.org/10.1016/j.sleep.2010.08.017
- Krachman SL, Chatila W, Martin UJ, Permut I, D’Alonzo GE, Gaughan JP, et al. Physiologic correlates of sleep quality in severe emphysema. COPD. 2011;8(3):182-188. https://doi.org/10.3109/15412555.2011.560583
- Calverley PM, Brezinova V, Douglas NJ, Catterall JR, Flenley DC. The effect of oxygenation on sleep quality in chronic bronchitis and emphysema. Am Rev Respir Dis. 1982;126(2):206-210.
- Agusti A, Hedner J, Marin JM, Barbé F, Cazzola M, Rennard S. Night-time symptoms: a forgotten dimension of COPD. Eur Respir Rev. 2011;20(121):183-194. https://doi.org/10.1183/09059180.00004311
- Budhiraja R, Siddiqi TA, Quan SF. Sleep disorders in chronic obstructive pulmonary disease: etiology, impact, and management. J Clin Sleep Med. 2015;11(3):259-270. https://doi.org/10.5664/jcsm.4540
- O’Donnell DE, Laveneziana P, Webb K, Neder JA. Chronic obstructive pulmonary disease: clinical integrative physiology. Clin Chest Med. 2014;35(1):51-69. https://doi.org/10.1016/j.ccm.2013.09.008
- Kwon JS, Wolfe LF, Lu BS, Kalhan R. Hyperinflation is associated with lower sleep efficiency in COPD with co-existent obstructive sleep apnea. COPD. 2009;6(6):441-445. https://doi.org/10.3109/15412550903433000
- Marrone O, Salvaggio A, Insalaco G. Respiratory disorders during sleep in chronic obstructive pulmonary disease. Int J Chron Obstruct Pulmon Dis. 2006;1(4):363-372. https://doi.org/10.2147/copd.2006.1.4.363
- Luo YM, He BT, Wu YX, Yuan H, Xu J, Moxham J, et al. Neural respiratory drive and ventilation in patients with chronic obstructive pulmonary disease during sleep. Am J Respir Crit Care Med. 2014;190(2):227-229. https://doi.org/10.1164/rccm.201402-0302LE
- Negewo NA, McDonald VM, Gibson PG. Comorbidity in chronic obstructive pulmonary disease. Respir Investig. 2015;53(6):249-258. https://doi.org/10.1016/j.resinv.2015.02.004
- Iber C, Ancoli-Israel S, Chesson AL, Quan S. The AASM Manual for the Scoring of Sleep and Associated Events: Rules, Terminology and Technical Specifications Westchester, IL: American Academy of Sleep Medicine; 2007.
- Kapur VK, Auckley DH, Chowdhuri S, Kuhlmann DC, Mehra R, Ramar K, et al. Clinical Practice Guideline for Diagnostic Testing for Adult Obstructive Sleep Apnea: An American Academy of Sleep Medicine Clinical Practice Guideline. J Clin Sleep Med. 2017;13(3):479-504. https://doi.org/10.5664/jcsm.6506
- CarsKadon M, Dement W. Normal human Sleep: An Overview. In: Krieger M, Roth T, Dement W, editors. Principles and Practice of Sleep Medicine, 2nd ed. Philadelphia: WB Saunders; 1994. p. 16-25. https://doi.org/10.1016/B978-1-4160-6645-3.00002-5
- Ohayon MM, Carskadon MA, Guilleminault C, Vitiello MV. Meta-analysis of quantitative sleep parameters from childhood to old age in healthy individuals: developing normative sleep values across the human lifespan. Sleep. 2004;27(7):1255-1273. https://doi.org/10.1093/sleep/27.7.1255
- Free Statistics Calculators, version 4.0 [homepage on the Internet]. Fullerton: Soper DS; c2006-2021; [cited 2020 Nov 1]. A-priori Sample Size Calculator for Multiple Regression. Available from: https://www.danielsoper.com/statcalc/calculator.aspx?id=1
- Kaplan KA, Hirshman J, Hernandez B, Stefanick ML, Hoffman AR, Redline S, et al. When a gold standard isn’t so golden: Lack of prediction of subjective sleep quality from sleep polysomnography. Biol Psychol. 2017;123:37-46. https://doi.org/10.1016/j.biopsycho.2016.11.010
- Westerlund A, Lagerros YT, Kecklund G, Axelsson J, Åkerstedt T. Relationships Between Questionnaire Ratings of Sleep Quality and Polysomnography in Healthy Adults. Behav Sleep Med. 2016;14(2):185-199. https://doi.org/10.1080/15402002.2014.974181
- Hoch CC, Reynolds CF 3rd, Kupfer DJ, Berman SR, Houck PR, Stack JA. Empirical note: self-report versus recorded sleep in healthy seniors. Psychophysiology. 1987;24(3):293-299. https://doi.org/10.1111/j.1469-8986.1987.tb00298.x
- Riedel BW, Lichstein KL. Objective sleep measures and subjective sleep satisfaction: how do older adults with insomnia define a good night’s sleep?. Psychol Aging. 1998;13(1):159-163. https://doi.org/10.1037/0882-7974.13.1.159
- Roth T. Characteristics and determinants of normal sleep. J Clin Psychiatry. 2004;65 Suppl 16:8-11.
- Ebrahim IO, Shapiro CM, Williams AJ, Fenwick PB. Alcohol and sleep I: effects on normal sleep. Alcohol Clin Exp Res. 2013;37(4):539-549. https://doi.org/10.1111/acer.12006
- McSharry DG, Ryan S, Calverley P, Edwards JC, McNicholas WT. Sleep quality in chronic obstructive pulmonary disease. Respirology. 2012;17(7):1119-1124. https://doi.org/10.1111/j.1440-1843.2012.02217.x
- Lange P, Halpin DM, O’Donnell DE, MacNee W. Diagnosis, assessment, and phenotyping of COPD: beyond FEV1. Int J Chron Obstruct Pulmon Dis. 2016;11 Spec Iss(Spec Iss):3-12. https://doi.org/10.2147/COPD.S85976
- Albuquerque AL, Nery LE, Villaça DS, Machado TY, Oliveira CC, Paes AT, et al. Inspiratory fraction and exercise impairment in COPD patients GOLD stages II-III. Eur Respir J. 2006;28(5):939-944. https://doi.org/10.1183/09031936.06.00040506
- Neder JA, Alharbi A, Berton DC, Alencar MC, Arbex FF, Hirai DM, et al. Exercise Ventilatory Inefficiency Adds to Lung Function in Predicting Mortality in COPD. COPD. 2016;13(4):416-424. https://doi.org/10.3109/15412555.2016.1158801
- Domnik NJ, James MD, Scheeren RE, Ayoo GA, Taylor SM, Di Luch AT, et al. Deterioration of Nighttime Respiratory Mechanics in COPD: Impact of Bronchodilator Therapy. Chest. 2021;159(1):116-127. https://doi.org/10.1016/j.chest.2020.06.033
- Chang CH, Chuang LP, Lin SW, Lee CS, Tsai YH, Wei YF, et al. Factors responsible for poor sleep quality in patients with chronic obstructive pulmonary disease. BMC Pulm Med. 2016;16(1):118. https://doi.org/10.1186/s12890-016-0281-6
- Elbehairy AF, O’Donnell CD, Abd Elhameed A, Vincent SG, Milne KM, James MD, et al. Low resting diffusion capacity, dyspnea, and exercise intolerance in chronic obstructive pulmonary disease. J Appl Physiol (1985). 2019;127(4):1107-1116. https://doi.org/10.1152/japplphysiol.00341.2019
- Lehmann S, Ringbæk T, Løkke A, Grote L, Hedner J, Lindberg E. A randomized trial to determine the impact of indacaterol/glycopyrronium on nighttime oxygenation and symptoms in patients with moderate-to-severe COPD: the DuoSleep study. Int J Chron Obstruct Pulmon Dis. 2019;14:199-210. https://doi.org/10.2147/COPD.S184127
- Neder JA, Berton DC, Müller PT, Elbehairy AF, Rocha A, Palange P, et al. Ventilatory Inefficiency and Exertional Dyspnea in Early Chronic Obstructive Pulmonary Disease. Ann Am Thorac Soc. 2017;14(Supplement_1):S22-S29. https://doi.org/10.1513/AnnalsATS.201612-1033FR
- Cooper DC, Ziegler MG, Milic MS, Ancoli-Israel S, Mills PJ, Loredo JS, et al. Endothelial function and sleep: associations of flow-mediated dilation with perceived sleep quality and rapid eye movement (REM) sleep. J Sleep Res. 2014;23(1):84-93. https://doi.org/10.1111/jsr.12083
- Cespuglio R, Amrouni D, Meiller A, Buguet A, Gautier-Sauvigné S. Nitric oxide in the regulation of the sleep-wake states. Sleep Med Rev. 2012;16(3):265-279. https://doi.org/10.1016/j.smrv.2012.01.006
- Putcha N, Drummond MB, Wise RA, Hansel NN. Comorbidities and Chronic Obstructive Pulmonary Disease: Prevalence, Influence on Outcomes, and Management. Semin Respir Crit Care Med. 2015;36(4):575-591. https://doi.org/10.1055/s-0035-1556063
- Donovan LM, Rise PJ, Carson SS, Feemster LC, Griffith MF, Kapur VK, et al. Sleep Disturbance in Smokers with Preserved Pulmonary Function and with Chronic Obstructive Pulmonary Disease. Ann Am Thorac Soc. 2017;14(12):1836-1843. https://doi.org/10.1513/AnnalsATS.201706-453OC








