ABSTRACT
Objective: Silicosis is a pneumoconiosis characterized by fibrosis of the lung parenchyma caused by inhalation of silica particles. Genetic factors might play a role in the severity silicosis. We sought to evaluate the influence of polymorphisms in the ACE, FAS, FASLG, NOS2, IL1RN, FAM13A, TGFB1, and TNF genes on the severity of silicosis. Methods: Nine polymorphisms were genotyped by PCR in a sample of 143 patients with silicosis in the state of Rio de Janeiro, Brazil. Results: Fifty-seven patients (40%) were classified as having simple silicosis and 86 (60%) were classified as having complicated silicosis. The TT genotype of rs1800469 in the TGFB1 gene showed a protective effect for complicated silicosis (OR = 0.35; 95% CI, 0.14-0.92; p = 0.028) when compared with the other two genotypes (CC+CT). The polymorphic T allele of rs763110 in the FASLG gene (OR = 0.56; 95% CI, 0.31-0.99; p = 0.047), as well as a dominant model for the T allele (TT+CT: OR = 0.37; 95% CI, 0.15-0.96; p = 0.037), also showed a protective effect. When patients with simple silicosis despite having been exposed to silica for a longer time (> 44,229 hours) were compared with patients with complicated silicosis despite having been exposed to silica for a shorter time, the T allele of rs763110 in the FASLG gene (OR = 0.20; 95% CI, 0.08-0.48; p < 0.0001), as well as dominant and recessive models (OR = 0.06; 95% CI, 0.00-0.49; p = 0.01 and OR = 0.22; 95% CI, 0.06-0.77; p = 0.014, respectively), showed a protective effect against the severity of silicosis. Conclusions: It appears that rs1800469 polymorphisms in the TGFB1 gene and rs763110 polymorphisms in the FASLG gene are involved in the severity of silicosis. Given the lack of studies relating genetic polymorphisms to the severity of silicosis, these results should be replicated in other populations.
Keywords:
Silicosis; Polymorphism, genetic; Genetic association studies; Cytokines.
RESUMO
Objetivo: A silicose é uma pneumoconiose caracterizada por fibrose do parênquima pulmonar causada por inalação de partículas de sílica. Fatores genéticos podem desempenhar um papel na gravidade da silicose. Nosso objetivo foi avaliar a influência de polimorfismos dos genes ACE, FAS, FASLG, NOS2, IL1RN, FAM13A, TGFB1 e TNF na gravi-dade da silicose. Métodos: Nove polimorfismos foram genotipados por meio de PCR em uma amostra composta por 143 pacientes com silicose no estado do Rio de Janeiro, Brasil. Resultados: A silicose foi classificada em simples em 57 (40%) dos pacientes e em complicada, em 86 (60%). O genótipo TT do polimorfismo rs1800469 do gene TGFB1 teve efeito protetor contra a silicose complicada (OR = 0,35; IC95%: 0,14-0,92; p = 0,028) em comparação com os outros dois genótipos (CC+CT). O alelo T polimórfico do polimorfismo rs763110 do gene FASLG (OR = 0,56; IC95%: 0,31-0,99; p = 0,047) e um modelo dominante do alelo T (TT+CT: OR = 0,37; IC95%: 0,15-0,96; p = 0,037) tam-bém tiveram efeito protetor. Quando se compararam os pacientes que tinham silicose simples com um tempo maior de exposição à sílica (> 44.229 horas) àqueles que tinham silicose complicada com um tempo menor de ex-posição à sílica, o alelo T do polimorfismo rs763110 do gene FASLG (OR = 0,20; IC95%: 0,08-0,48; p < 0,0001) e mode-los dominantes e recessivos (OR = 0,06; IC95%: 0,00-0,49; p = 0,01 e OR = 0,22; IC95%: 0,06-0,77; p = 0,014, respecti-vamente) tiveram efeito protetor contra a gravidade da silicose. Conclusões: Polimorfismos rs1800469 do gene TGFB1 e polimorfismos rs763110 do gene FASLG parecem estar envolvidos na gravidade da silicose. Como há pou-cos estudos que tenham estabelecido relações entre polimorfismos genéticos e a gravidade da silicose, esses re-sultados devem ser replicados em outras populações.
Palavras-chave:
Silicose; Polimorfismo genético; Estudos de associação genética; Citocinas.
INTRODUÇÃO A silicose é a pneumoconiose mais prevalente no mundo e é caracterizada por fibrose do parênquima pulmonar causada por inalação de partículas de sílica. (1) A silicose é uma doença ocupacional que pode acometer trabalhadores da indústria extrativa mineral, de processamento de minérios, de transformação, de cosméticos e de jateamento de areia, entre outras.(2,3) O desenvolvimento da silicose está relacionado com o tempo e grau de exposição a partículas de sílica; deficiências nos sistemas imunes; depuração pulmonar prejudicada; tabagismo; a concentração de partículas de sílica; o uso (ou a falta de uso) de equipamento de proteção individual (EPI); fatores genéticos.(4,5) Fatores genéticos poderiam explicar distintas expressões fenotípicas da doença em pacientes com história semelhante de exposição.(4,5)
No espaço alveolar, as partículas de sílica desencadeiam diversos mecanismos inflamatórios e vias inflamatórias responsáveis pela patogênese da silicose, representados por ciclos de lesão e cicatrização. Esses ciclos geram intenso dano epitelial que causa grave comprometimento das trocas gasosas por meio da deposição de fibras colágenas no espaço alveolar e são divididos nas seguintes etapas: citotoxicidade direta; geração de espécies reativas de oxigênio e nitrogênio; intensa produção de citocinas; deposição de fibras colágenas; fibrose; apoptose de células alveolares; liberação de cristais no espaço alveolar, reiniciando o ciclo.(1)
As partículas de sílica levam à produção intensiva de espécies reativas de oxigênio e nitrogênio, principalmente por células epiteliais alveolares e macrófagos. A atividade da enzima óxido nítrico sintase induzível é fundamental para esse ambiente oxidativo, pois atua na produção de óxido nítrico.(6) Esse ambiente oxidativo intenso promove a liberação de diversas interleucinas. A IL-1 (IL-1α e IL-1β) atua na ativação de fibroblastos e na deposição de fibras colágenas no espaço alveolar. No entanto, o antagonista do receptor de IL-1 (IL1RA) atua bloqueando a ação da IL-1.(7) O TNF-α atua no recrutamento e proliferação de fibroblastos e como ligante para receptores de apoptose.(1) O TGFB1 atua na proliferação, diferenciação, migração, inflamação e apoptose celular, bem como no reparo tecidual. (8) A angiotensin-converting enzyme (ACE, enzima conversora de angiotensina), liberada por diversas células epiteliais e por macrófagos, é um importante biomarcador de lesão pulmonar.(9) A proteína family with sequence similarity 13 member A (FAM13A) se expressa nas vias aéreas em células epiteliais do tipo II e em macrófagos alveolares, e parece desempenhar um papel na patogênese da fibrose pulmonar idiopática.(10)
A apoptose de macrófagos alveolares também contribui para a patogênese da silicose, por meio do aumento da expressão de Fas cell surface death receptor (FAS) e seus ligantes [ligante Fas (FASLG) e TNF-α]. A apoptose de macrófagos alveolares libera mediadores inflamatórios, promovendo novo recrutamento de células inflamatórias e ativação repetida de vias inflamatórias.(1)
A silicose é uma doença irreversível e incurável. A identificação de polimorfismos genéticos é essencial para a identificação precoce de pacientes com maior probabilidade de apresentar maior gravidade da doença, possibilitando o estabelecimento de estratégias adequadas de seguimento e a decisão a respeito do uso de antifibróticos.(11) O objetivo do presente estudo foi avaliar a influência de polimorfismos dos genes ACE (rs4646994), FAS (rs2234767), FASLG (rs763110), nitric oxide synthase 2 — NOS2, óxido nítrico sintase 2 — (rs2297518), IL1RN (rs419598 e rs2234663), FAM13A (rs2609255), TGFB1 (rs1800469) e TNF (rs1800629) na gravidade da silicose em pacientes no Brasil.
MÉTODOS Pacientes A amostra do estudo foi composta por 143 pacientes com diagnóstico de silicose baseado em história ocupacional de exposição a partículas de sílica e achados radiológicos compatíveis com silicose, em conformidade com a International Classification of Radiographs of Pneumoconioses (Classificação Internacional de Radiografias de Pneumoconioses) da International Labour Organization (ILO, Organização Internacional do Trabalho).(12) Pacientes com doenças pulmonares ocupacionais que não a silicose foram excluídos.
Os pacientes incluídos no estudo foram atendidos no Hospital Universitário Antônio Pedro da Universidade Federal Fluminense, no Hospital Universitário Pedro Ernesto da Universidade do Estado do Rio de Janeiro ou na Escola Nacional de Saúde Pública da Fundação Oswaldo Cruz, no estado do Rio de Janeiro, Brasil. Todos os pacientes foram afastados do trabalho em virtude do diagnóstico confirmado de silicose.
Com base nos achados da radiografia de tórax, os pacientes foram classificados em pacientes com silicose simples (ou opacidades pequenas, isto é, menores que 1,0 cm) e pacientes com silicose complicada (ou opacidades grandes, isto é, pelo menos uma opacidade maior que 1,0 cm), em conformidade com a Classificação Internacional de Radiografias de Pneumoconioses da ILO.(12) As radiografias foram obtidas por meio do aparelho LX30 (Siemens AG, Erlangen, Alemanha) e foram analisadas separadamente por três avaliadores habilitados pela ILO. Todos os participantes do estudo assinaram um termo de consentimento livre e esclarecido, e o estudo foi aprovado pelos comitês de ética em pesquisa das instituições envolvidas.
Características sociodemográficas e clínicas, e parâmetros de função pulmonar Características sociodemográficas e clínicas como idade (em anos), profissão, peso (em kg), estatura (em m), IMC (em kg/m2), tempo de exposição à sílica (em anos), total de horas trabalhadas por semana, tempo de exposição à sílica (em horas), tempo decorrido desde o afastamento da exposição (em anos), carga tabágica (em anos-maço), uso de EPI e tuberculose foram avaliadas por meio de um questionário.
Os parâmetros de função pulmonar foram obtidos por meio de espirometria, que foi realizada com um espirômetro MS-PFT (Jaeger, Würzburg, Alemanha) e em conformidade com os padrões da American Thoracic Society/European Respiratory Society(13) e os métodos padronizados da Sociedade Brasileira de Pneumologia e Tisiologia.(14,15) O VEF1, a CVF e a relação VEF1/CVF foram avaliados em todos os pacientes.
Genotipagem Para a coleta do material genético, foram obtidas amostras de células da cavidade oral por meio de lavagem com 5 mL de solução salina (NaCl a 0,5%) durante 60 s. As amostras foram então identificadas e imediatamente armazenadas em freezer a −4°C. A extração do DNA genômico foi realizada em conformidade com Aidar & Line.(16)
A genotipagem foi realizada por meio de PCR. A PCR padrão foi usada para analisar o número variável de repetições em tandem de 2018T/C (rs419598) e 86 pb (rs2234663) no gene IL1RN, bem como Ins/Del (rs4646994) no gene ACE. A PCR e os primers (iniciadores) usados foram conforme descrito anteriormente.(9,17,18) Para o polimorfismo rs4646994 do gene ACE, os alelos consistiram em um fragmento de 190 pb (alelo D) e um fragmento de 490 pb (alelo I), detectados por eletroforese dos produtos da PCR em gel de agarose a 2%. Para o polimorfismo rs2234663 do gene IL1RN, os genótipos foram estabelecidos de acordo com o tamanho dos produtos da PCR em gel de agarose a 2,5%: IL1RN*1 410 pb (quatro repetições); IL1RN*2 240 pb (duas repetições); IL1RN*3 500 pb (cinco repetições); IL1RN*4 325 pb (três repetições) e IL1RN*5 595 pb (seis repetições).
A genotipagem do polimorfismo rs419598 foi realizada por meio de PCR e, em seguida, RFLP com 1 U de MspI, em conformidade com as instruções do fabricante (New England Biolabs, Ipswich, MA, EUA). A eletroforese em gel de agarose a 3% revelou três tamanhos de fragmentos de PCR: 123 pb e 233 pb (alelo C), e 356 pb (alelo T).
A genotipagem do polimorfismo rs2609255 do gene FAM13A, do polimorfismo rs2234767 (−1377G/A) do gene FAS, do polimorfismo rs763110 (−844C/T) do gene FASLG, do polimorfismo rs2297518 (Ser608Leu) do gene NOS2, do polimorfismo rs1800469 (−509C/T) do gene TGFB1 e do polimorfismo rs1800629 (−308G/A) do gene TNF foi realizada por meio de PCR em tempo real com ensaios TaqMan® pré-projetados e validados (C_15906608_10, C_12123966_10, C_3175437_10, C_11889257_10, C_8708473_10 e C_7514879_10, respectivamente; Thermo Fisher Scientific, Waltham, MA, EUA). O protocolo de genotipagem seguiu as instruções do fabricante (Thermo Fisher Scientific), e as amostras foram processadas em um sistema de PCR em tempo real (CFX96; Bio-Rad Laboratories, Inc., Hercules, CA, EUA).
Análise estatística As frequências alélicas foram obtidas por contagem de genes. Desvios do equilíbrio de Hardy-Weinberg foram avaliados por meio do teste do qui-quadrado. As análises de associação entre polimorfismos genéticos e a gravidade da silicose (simples vs. complicada) foram avaliadas por meio do teste do qui-quadrado ou do teste exato de Fisher. Os dados quantitativos com distribuição normal (determinada por meio do teste de Kolmogorov-Smirnov) foram avaliados por meio de um teste t, ao passo que os dados quantitativos com distribuição não normal foram avaliados por meio do teste de Mann-Whitney. Os valores foram apresentados em forma de média ± desvio padrão. O total de horas de exposição à sílica foi obtido por meio do ajuste do total de horas trabalhadas por semana em cada mês (11 meses de trabalho), multiplicado pelo total de anos trabalhados. O tempo decorrido desde o afastamento da exposição (em anos) foi calculado pela diferença entre o ano do diagnóstico de silicose (e afastamento do trabalho) e o ano da coleta das amostras e classificação em silicose simples e complicada.
A análise de regressão logística multivariada foi usada para avaliar as OR e IC95% para preditores independentes de silicose complicada. O modelo de regressão logística incluiu as seguintes variáveis independentes: polimorfismos significativamente associados à gravidade da silicose, tempo total de exposição à sílica > 44.229 horas, tempo decorrido desde o afastamento da exposição (em anos) e falta de uso de EPI. O nível de significância adotado foi de p < 0,05. Todos os testes estatísticos foram realizados por meio do programa IBM SPSS, versão 20.0 (IBM Corporation, Armonk, NY, EUA).
RESULTADOS Características sociodemográficas e clínicas, e parâmetros de função pulmonar Dos 143 pacientes, 57 (40%) foram considerados pacientes com silicose simples e 86 (60%) foram considerados pacientes com silicose complicada. Jateamento de areia foi a atividade profissional mais comum, em 66 pacientes (46%), seguida de marmoraria, em 21 (14,7%), e martelagem, em 18 (12,6%). Setenta e seis pacientes (53%) apresentavam história de tabagismo. Destes, 27 (35,5%) apresentavam silicose simples e 49 (64,5%) apresentavam silicose complicada (p = 0,260). Ao que se refere à tuberculose, 70 pacientes (49%) apresentavam história de tuberculose. Destes, 25 (35,7%) apresentavam silicose simples e 45 (64,3%) apresentavam silicose complicada (p = 0,321). No Quanto ao uso de EPI, 54 (37,8%) relataram não usar EPI no trabalho. Destes, 20 (37%) apresentavam silicose simples e 34 (63%) apresentavam silicose complicada (p = 0,101). Outras características clínicas e demográficas são apresentadas na Tabela 1.
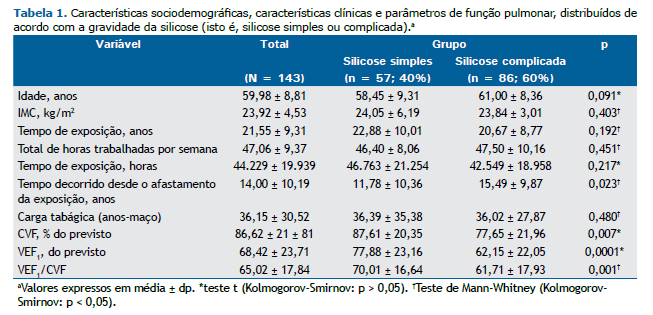
Foi observada uma diferença estatisticamente significativa entre os pacientes com silicose simples e aqueles com silicose complicada quanto ao tempo decorrido desde o afastamento da exposição (p = 0,023). Acerca dos parâmetros de função pulmonar, foi observada uma diferença estatisticamente significativa entre os pacientes com silicose simples e aqueles com silicose complicada quanto à CVF em % do previsto (p = 0,007), ao VEF1 (p = 0,0001) e à relação VEF1/CVF (p = 0,001; Tabela 1).
Análise de associação entre polimorfismos genéticos e a gravidade da silicose As frequências genotípicas de todos os polimorfismos na amostra total não apresentaram desvio significativo do equilíbrio de Hardy-Weinberg. As associações entre a gravidade da silicose (silicose simples vs. silicose complicada) e os polimorfismos genéticos investigados no presente estudo foram significativamente diferentes para −844C>T (rs763110) no gene FASLG e −509C>T (rs1800469) no gene TGFB1 (Tabela 2). O alelo T polimórfico de rs763110 no gene FASLG teve efeito protetor contra a silicose complicada (OR = 0,56; IC95%: 0,31-0,99; p = 0,047). Em um modelo dominante, portadores do alelo T (TT+CT) também apresentaram esse efeito protetor (OR = 0,37; IC95%: 0,15-0,96; p = 0,037; Tabela 2).
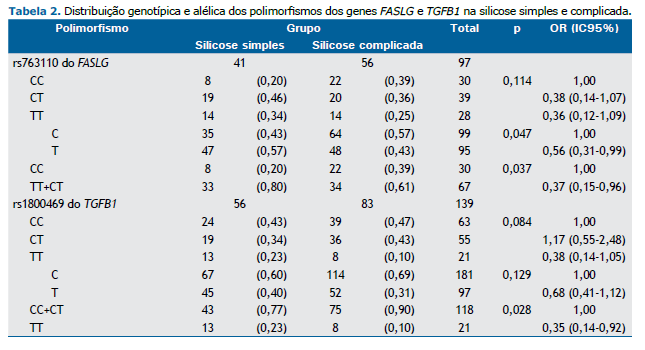
O polimorfismo −509C>T (rs1800469) do gene TGFB1 teve efeito protetor significativo em um modelo recessivo do alelo T. Como se pode observar na Tabela 2, o genótipo TT foi mais comum que os outros dois genótipos (CC+CT) em pacientes com silicose simples (OR = 0,35; IC95%: 0,14-0,92; p = 0,028). Quanto aos demais polimorfismos, não foram observadas associações significativas (Tabela 2).
Não foram observadas diferenças significativas entre os pacientes com silicose simples e aqueles com silicose complicada quanto aos demais polimorfismos: rs4646994 do gene ACE (p = 0,171), rs2234767 do gene FAS (p = 0,709), rs2609255 do gene FAM13A (p = 0,402), rs419598 do gene IL1RN (p = 0,804), rs2234663 do gene IL1RN (p = 0,978), rs2297518 do gene NOS2 (p = 0,221) e rs1800629 do gene TNF-α (p = 0,289; dados não apresentados).
Análise de associação entre polimorfismos genéticos e a gravidade da silicose, com base no total de horas de exposição à sílica Usando a média do número de horas de exposição à sílica na amostra como um todo (44.229 horas), comparamos as distribuições genotípicas e alélicas em pacientes com silicose simples com exposição à sílica > 44.229 horas e pacientes com silicose complicada com exposição à sílica < 44.229 horas. Nosso objetivo foi comparar pacientes que tinham silicose simples não obstante o maior tempo de exposição à sílica àqueles que tinham silicose complicada não obstante o menor tempo de exposição à sílica. Observamos uma associação significativa entre os dois grupos de pacientes e o polimorfismo rs763110 do gene FASLG.
O alelo T teve efeito protetor contra a silicose complicada com exposição maior à sílica (OR = 0,20; IC95%: 0,08-0,48; p < 0,0001). Isso também foi observado em modelos dominantes e recessivos do alelo T (OR = 0,06; IC95%: 0,00-0,49; p = 0,01 e OR = 0,22; IC95%: 0,06-0,77; p = 0,014, respectivamente; Tabela 3).
Análise de regressão logística multivariada A Tabela 4 mostra os resultados da análise de regressão logística multivariada de preditores independentes da gravidade da silicose. Os genótipos TT+TC do gene FASLG revelaram-se preditores de proteção contra silicose complicada após o controle de fatores de risco (OR = 0,15; IC95%: 0,03-0,75; p = 0,021), ao passo que nenhum efeito foi observado para o genótipo TT do gene TGFB1. A falta de uso de EPI e um maior tempo decorrido desde o afastamento da exposição também foram importantes fatores de risco independentes de silicose complicada (OR = 6,40; IC95%: 1,47-27,86; p = 0,013 e OR = 1,09; IC95%: 1,01-1,17; p = 0,027, respectivamente).
DISCUSSÃO A história de exposição a partículas de sílica é o mais importante de todos os fatores ambientais relacionados à silicose.(19) No entanto, diferenças fenotípicas poderiam ser explicadas por respostas individuais à exposição, e variações genéticas poderiam influenciar essas respostas.(4,19) Neste estudo, avaliamos a associação entre diversos polimorfismos e a gravidade da silicose em trabalhadores expostos à sílica no Brasil e observamos associações significativas entre a gravidade da doença e os genes TGFB1 e FASLG.
A TGFB1 é uma citocina multifuncional que regula a proliferação e diferenciação de diversos tipos celulares e está diretamente envolvida na fibrose do parênquima pulmonar. Essa citocina pode se ligar a três receptores (tipos I, II e III), no mínimo. Os efeitos da TGFB1 na síntese e deposição da matriz extracelular são mediados por receptores do tipo I; os efeitos da TGFB1 no crescimento e proliferação celular são mediados por receptores do tipo II; os receptores do tipo III inibem a ligação da TGFB1 aos receptores da membrana celular, inibindo sua ação.(20) A fibrose representa um evento patológico de um processo normal de reparo tecidual. Portanto, a produção excessiva ou persistente de TGFB1 torna-se um ponto fundamental para a fibrose tecidual. Em modelos animais e humanos, a lesão tecidual limitada é acompanhada por um aumento transitório de TGFB1, sem progressão para fibrose. Na presença de lesão repetitiva, a produção de TGFB1 é mantida, levando à deposição progressiva de matriz extracelular e fibrose.(20) O mecanismo envolvido na manutenção da expressão de TGFB1 em consequência de lesão repetitiva ainda é pouco compreendido.(20)
O polimorfismo do promotor rs1800469 (−509C/T) do gene TGFB1 altera os níveis de produção e secreção de TGFB1.(21) Os níveis plasmáticos de TGFB1 são duas vezes mais altos em pacientes homozigotos para o alelo T em comparação com indivíduos homozigotos para o alelo C; os heterozigotos apresentam produção intermediária.(21,22) Em uma meta-análise realizada por Deng et al. com sete estudos (um total de 4.333 pacientes com pneumoconiose e 3.478 controles), observou-se uma associação significativa entre o polimorfismo rs1800469 e o risco de pneumoconiose. (8) Wu et al. realizaram um estudo de associação do polimorfismo rs1800469 em 183 pacientes com silicose e 111 controles e não observaram nenhuma associação significativa.(21) Em nosso estudo, o genótipo TT foi um fator protetor contra a gravidade da silicose.
A divergência de resultados pode ter ocorrido em virtude do fato de que a TGFB1 também atua como agente anti-inflamatório na silicose, desempenhando um papel importante no início e término do reparo tecidual após uma agressão, levando à remodelação tecidual.(20) Isso foi confirmado por Barbarin et al.,(23) que demonstraram que a patogênese da silicose envolve uma complexa interação entre vias inflamatórias e anti-inflamatórias. A TGFB1 estimula fibroblastos e células musculares lisas a produzirem elastina, além de estimular a produção de mediadores inflamatórios.(24) A TGFB1 também atua como agente anti-inflamatório, promovendo o acúmulo de matriz extracelular por meio da diminuição da síntese de colagenase; da repressão dos efeitos estimuladores dos fatores de crescimento na expressão do gene da colagenase e do aumento da produção de inibidores da colagenase.(24) Além disso, a TGFB1 atua em todas as etapas do reparo tecidual, inibindo células T e B e seus produtos (TNF-α e IL-1) e modulando a citotoxicidade dos macrófagos, incluindo a supressão da produção de superóxido e óxido nítrico.(25)
Estudos experimentais demonstraram que a administração de TGFB1 resulta em normalização do processo de dano tecidual.(26) Além disso, as diferentes expressões de seus receptores (I, II e III) e interações com TGFB1 podem causar um desequilíbrio entre as vias inflamatórias e anti-inflamatórias. Não há estudos nos quais se tenha avaliado a associação entre polimorfismos do gene TGFBR1 e a silicose ou outras pneumoconioses. Também não há estudos nos quais se tenha avaliado a associação entre polimorfismos dos genes TGFB1 e TGFBR1 e a silicose ou outras pneumoconioses. No entanto, alguns estudos investigaram outras doenças. Grigorova et al.(27) avaliaram a associação entre o polimorfismo rs1800469 do gene TGFB1 e o polimorfismo rs3087465 do gene TGFBR2 e episódios frequentes de atividade da doença em pacientes com esclerose múltipla. Os autores observaram maior concentração de TGFB1 determinada pelo genótipo TGFB1 em combinação com o genótipo TGFBR2 e concluíram que essa combinação atuou como fator protetor contra a esclerose múltipla remitente-recorrente.(27) Jin et al.(28) analisaram a associação entre os polimorfismos supracitados e o carcinoma de células escamosas do esôfago. Os autores concluíram que indivíduos portadores de genótipos variantes desses polimorfismos apresentavam risco significativamente reduzido de carcinoma de células escamosas do esôfago.
A apoptose desempenha um papel importante na fisiopatologia da silicose.(29) O receptor FAS, localizado em 10q24.1, é um membro potente da família de receptores de apoptose e desempenha um papel fundamental na sinalização da apoptose de diversas células. Esse receptor interage com seu ligante (FASLG), iniciando a cascata de morte celular por apoptose.(30) No sistema FAS/FASLG, o receptor FAS é expresso em diversas células de diversos tecidos, ao passo que o FASLG é restrito a células do sistema imunológico, tais como células T ativadas e células natural killer.(31) Borges et al.(32) investigaram o papel do FASLG na silicose e observaram que cobaias com deficiência de FASLG eram resistentes à silicose em virtude da apoptose reduzida de macrófagos. Além disso, o tratamento com um anticorpo antagonista anti-FASLG preveniu a doença.(32)
No presente estudo, o alelo T do polimorfismo rs763110 do gene FASLG teve efeito protetor na gravidade da doença, mesmo quando comparamos pacientes com silicose simples e maior tempo de exposição à sílica àqueles com silicose complicada e menor tempo de exposição à sílica. Estudos mostram que o alelo T desse polimorfismo leva a uma menor expressão do gene FASLG,(33) pois o genótipo TT também leva à supressão da apoptose pela redução da ligação do promotor do gene FASLG a fatores de transcrição.(34) Cooke et al. demonstraram que o alelo C desse polimorfismo causa maior expressão basal de FASLG do que o alelo T.(35) Wu et al.(4) analisaram a influência desse polimorfismo na suscetibilidade à silicose e não observaram nenhuma associação significativa. Por outro lado, em nosso estudo, é possível que o efeito protetor do polimorfismo rs763110 do gene FASLG na gravidade da silicose tenha ocorrido em virtude da redução da apoptose causada pela presença do alelo T em pacientes com silicose simples.
Nossa análise de regressão logística multivariada de preditores independentes da gravidade da silicose revelou que os genótipos TT+TC do gene FASLG constituíram um fator protetor independente contra silicose complicada (OR = 0,15; IC95%: 0,03-0,75; p = 0,021). A análise revelou também que a falta de uso de EPI (OR = 6,40; IC95%: 1,47-27,86; p = 0,013) foi um fator de risco independente de silicose complicada. Recentemente, Requena-Mullor et al. estudaram a silicose em trabalhadores no setor de fabricação de pedras artificiais e demonstraram que usar apenas uma máscara simples e não usar o EPI fornecido pela empresa eram fatores que aumentavam o risco de silicose.(36) Nossa análise multivariada também revelou que um tempo maior decorrido desde o afastamento da exposição também foi um fator de risco independente de silicose complicada (OR = 1,09; IC95%: 1,01-1,17; p = 0,027). Na silicose, a fibrose pode progredir em consequência do processo inflamatório causado pela poeira de sílica, mesmo após o afastamento da exposição. Portanto, a silicose tende a progredir mesmo em pacientes afastados da exposição ocupacional há muito tempo.
O presente estudo tem limitações, incluindo a impossibilidade de analisar todas as vias patogênicas da silicose, incluindo os receptores de IL; a presença de viés de memória (o tempo exato de exposição e o número exato de horas trabalhadas por semana); EPI apropriado e seu uso; e o pequeno tamanho da amostra. Outra limitação é que analisamos as radiografias de tórax e classificamos os achados com base na Classificação Internacional de Radiografias de Pneumoconioses da ILO.(12) No entanto, vários estudos mostram maior sensibilidade com o uso da TC de tórax na avaliação da profusão de opacidades no parênquima pulmonar em pacientes com silicose.(37-39) Outra limitação do estudo está relacionada à inclusão de pacientes com tuberculose, que sabidamente promove a progressão das lesões parenquimatosas causadas pela silicose. No entanto, a exclusão desses pacientes resultaria em uma amostra pequena e que não seria representativa do perfil dos pacientes com silicose no Brasil.
Em suma, a fisiopatologia da silicose é extremamente complexa, englobando vias inflamatórias e anti-inflamatórias. Polimorfismos de genes relacionados a diversos mecanismos imunológicos poderiam causar um desequilíbrio entre fatores inflamatórios e anti-inflamatórios, explicando a expressão de fenótipos distintos. Este estudo identificou uma diferença estatisticamente significativa na prevalência de polimorfismos dos genes TGFB1 e FASLG, que atuaram como fatores protetores contra a gravidade da doença. Mais estudos devem ser realizados na tentativa de ampliar o tamanho da amostra e analisar as associações entre polimorfismos genéticos e mecanismos fisiopatológicos.
AGRADECIMENTOS Gostaríamos de agradecer a todos os pacientes que se voluntariaram para participar deste estudo, bem como a seus familiares.
CONFLITOS DE INTERESSE Nenhum declarado.
CONTRIBUIÇÕES DOS AUTORES FBK e ASFN: concepção e desenho do estudo; MCSC, ASFN, KCRS, HC, PC, WC e FBK: coleta de amostras; MCSC, KCRS, JFBS, CBMN e FBK: coleta, análise e interpretação dos dados; MCSC, JMR e FBK: redação e revisão crítica do manuscrito; MCSC, ASFN, KCRS, JFBS, JMR, HC, PC, WC, CBMN e FBK: aprovação da versão enviada para avaliação.
REFERÊNCIAS 1. Lopes-Pacheco M, Bandeira E, Morales MM. Cell-Based Therapy for Silicosis. Stem Cells Int. 2016;2016:5091838. https://doi.org/10.1155/2016/5091838
2. Hoy RF, Baird T, Hammerschlag G, Hart D, Johnson AR, King P, et al. Artificial stone-associated silicosis: a rapidly emerging occupational lung disease. Occup Environ Med. 2018;75(1):3-5. https://doi.org/10.1136/oemed-2017-104428
3. The Lancet Respiratory Medicine. The world is failing on silicosis. Lancet Respir Med. 2019;7(4):283. https://doi.org/10.1016/S2213-2600(19)30078-5
4. Wu F, Xia Z, Qu Y, Tang Y, Cao D, Sun P, Christiani DC. Genetic polymorphisms of IL-1A, IL-1B, IL-1RN, NFKB1, FAS, and FASL, and risk of silicosis in a Chinese occupational population. Am J Ind Med. 2008;51(11):843-851. https://doi.org/10.1002/ajim.20616
5. Fernández Álvarez R, Martínez González C, Quero Martínez A, Blanco Pérez JJ, Carazo Fernández L, Prieto Fernández A. Guidelines for the diagnosis and monitoring of silicosis. Arch Bronconeumol. 2015;51(2):86-93. https://doi.org/10.1016/j.arbres.2014.07.010
6. Qu Y, Tang Y, Cao D, Wu F, Liu J, Lu G, et al. Genetic polymorphisms in alveolar macrophage response-related genes, and risk of silicosis and pulmonary tuberculosis in Chinese iron miners. Int J Hyg Environ Health. 2007;210(6):679-689. https://doi.org/10.1016/j.ijheh.2006.11.010
7. Zhou Y, Kang Y, Zhang Z, Liu J. IL-1RA +2018 polymorphism and the susceptivity to pneumoconiosis: a Meta-analysis. Int J Clin Exp Med. 2014;7(8):2204-2208.
8. Deng CW, Zhang XX, Lin JH, Huang LF, Qu YL, Bai C. Association between Genetic Variants of Transforming Growth Factor-β1 and Susceptibility of Pneumoconiosis: A Meta-analysis. Chin Med J (Engl). 2017;130(3):357-364. https://doi.org/10.4103/0366-6999.198917
9. Mohebbi I, Abdi Rad I, Bagheri M. Association of angiotensin-1-converting enzyme gene variations with silicosis predisposition. Inhal Toxicol. 2010;22(13):1110-1115. https://doi.org/10.3109/08958378.2010.526654
10. Hirano C, Ohshimo S, Horimasu Y, Iwamoto H, Fujitaka K, Hamada H, et al. FAM13A polymorphism as a prognostic factor in patients with idiopathic pulmonary fibrosis. Respir Med. 2017;123:105-109. https://doi.org/10.1016/j.rmed.2016.12.007
11. Flaherty KR, Wells AU, Cottin V, Devaraj A, Walsh SLF, Inoue Y, et al. Nintedanib in Progressive Fibrosing Interstitial Lung Diseases. N Engl J Med. 2019;381(18):1718-1727. https://doi.org/10.1056/NEJMoa1908681
12. International Labour Organization (ILO). Guidelines for the use of ILO International classification of radiographs of pneumoconioses, rev ed. Occupational Safety and Health Series n. 22. Geneva: ILO; 2011.
13. Graham BL, Steenbruggen I, Miller MR, Barjaktarevic IZ, Cooper BG, Hall GL, et al. Standardization of Spirometry 2019 Update. An Official American Thoracic Society and European Respiratory Society Technical Statement. Am J Respir Crit Care Med. 2019;200(8):e70-e88. https://doi.org/10.1164/rccm.201908-1590ST
14. Neder JA, Andreoni S, Castelo-Filho A, Nery LE. Reference values for lung function tests. I. Static volumes. Braz J Med Biol Res. 1999;32(6):703-717. https://doi.org/10.1590/S0100-879X1999000600006
15. Pereira CA, Sato T, Rodrigues SC. New reference values for forced spirometry in white adults in Brazil. J Bras Pneumol. 2007;33(4):397-406. https://doi.org/10.1590/S1806-37132007000400008
16. Aidar M, Line SR. A simple and cost-effective protocol for DNA isolation from buccal epithelial cells. Braz Dent J. 2007;18(2):148-152. https://doi.org/10.1590/S0103-64402007000200012
17. Kim SK, Kang SW, Chung JH, Lee JS, Park HK, Yoon KL, et al. Coding single-nucleotide polymorphisms of interleukin-1 gene cluster are not associated with Kawasaki disease in the Korean population. Pediatr Cardiol. 2011;32(4):381-385. https://doi.org/10.1007/s00246-010-9858-7
18. Rad IA, Mohebbi I, Bagheri M. Molecular Evaluation of the IFN γ +874, TNF α -308, and IL-1Ra VNTR Sequences in Silicosis. Maedica (Bucur). 2012;7(1):20-24.
19. Wagner GR. Asbestosis and silicosis. Lancet. 1997;349(9061):1311-1315. https://doi.org/10.1016/S0140-6736(96)07336-9
20. Border WA, Noble NA. Transforming growth factor beta in tissue fibrosis. N Engl J Med. 1994;331(19):1286-1292. https://doi.org/10.1056/NEJM199411103311907
21. Wu F, Qu Y, Tang Y, Cao D, Sun P, Xia Z. Lack of association between cytokine gene polymorphisms and silicosis and pulmonary tuberculosis in Chinese iron miners. J Occup Health. 2008;50(6):445-454. https://doi.org/10.1539/joh.L8006
22. Grainger DJ, Heathcote K, Chiano M, Snieder H, Kemp PR, Metcalfe JC, et al. Genetic control of the circulating concentration of transforming growth factor type beta1. Hum Mol Genet. 1999;8(1):93-97. https://doi.org/10.1093/hmg/8.1.93
23. Barbarin V, Nihoul A, Misson P, Arras M, Delos M, Leclercq I, et al. The role of pro- and anti-inflammatory responses in silica-induced lung fibrosis. Respir Res. 2005;6(1):112. https://doi.org/10.1186/1465-9921-6-112
24. Jagirdar J, Begin R, Dufresne A, Goswami S, Lee TC, Rom WN. Transforming growth factor-beta (TGF-beta) in silicosis. Am J Respir Crit Care Med. 1996;154(4 Pt 1):1076-1081. https://doi.org/10.1164/ajrccm.154.4.8887610
25. Vodovotz Y, Bogdan C, Paik J, Xie QW, Nathan C. Mechanisms of suppression of macrophage nitric oxide release by transforming growth factor beta. J Exp Med. 1993;178(2):605-613. https://doi.org/10.1084/jem.178.2.605
26. Terrell TG, Working PK, Chow CP, Green JD. Pathology of recombinant human transforming growth factor-beta 1 in rats and rabbits. Int Rev Exp Pathol. 1993;34 Pt B:43-67. https://doi.org/10.1016/B978-0-12-364935-5.50009-2
27. Grigorova A, Trenova A, Stanilova S. A link between promoter polymorphisms of the transforming growth factor b1 (TGFB1) and TGF-b1 receptor II (TGFBR2) genes and relapsing-remitting multiple sclerosis. Folia Neuropathol. 2020;58(4):307-316. https://doi.org/10.5114/fn.2020.102433
28. Jin G, Deng Y, Miao R, Hu Z, Zhou Y, Tan Y, et al. TGFB1 and TGFBR2 functional polymorphisms and risk of esophageal squamous cell carcinoma: a case-control analysis in a Chinese population. J Cancer Res Clin Oncol. 2008;134(3):345-351. https://doi.org/10.1007/s00432-007-0290-1
29. Yao SQ, Rojanasakul LW, Chen ZY, Xu YJ, Bai YP, Chen G, et al. Fas/FasL pathway-mediated alveolar macrophage apoptosis involved in human silicosis. Apoptosis. 2011;16(12):1195-1204. https://doi.org/10.1007/s10495-011-0647-4
30. Suda T, Takahashi T, Golstein P, Nagata S. Molecular cloning and expression of the Fas ligand, a novel member of the tumor necrosis factor family. Cell. 1993;75(6):1169-1178. https://doi.org/10.1016/0092-8674(93)90326-L
31. Yu X, Li Y, Yu Y, Lei J, Wan G, Cao F. Associations between FAS rs2234767 and FASL rs763110 polymorphisms and the risk of lung cancer: a meta-analysis of 39,736 subjects. Onco Targets Ther. 2016;9:2049-2056. https://doi.org/10.2147/OTT.S102723
32. Borges VM, Falcão H, Leite-Júnior JH, Alvim L, Teixeira GP, Russo M, et al. Fas ligand triggers pulmonary silicosis. J Exp Med. 2001;194(2):155-164. https://doi.org/10.1084/jem.194.2.155
33. Huang P, Wang CH, Zhuo LY, Xia XS, Yang S, Zhang JW, et al. Polymorphisms rs763110 in FASL is linked to hepatitis C virus infection among high-risk populations. Br J Biomed Sci. 2020;77(3):112-117. https://doi.org/10.1080/09674845.2020.1747182
34. Wu S, Wang S, Fu Y, Tang W, Jin H, Meng Q, et al. A novel mechanism of rs763110 polymorphism contributing to cervical cancer risk by affecting the binding affinity of C/EBPβ and OCT1 complex to chromatin. Int J Cancer. 2017;140(4):756-763. https://doi.org/10.1002/ijc.30490
35. Khalifa RH, Bahgat DM, Darwish HA, Shahin RM. Significant association between FasL gene -844T/C polymorphism and risk to hepatocellular carcinoma in Egyptian patients. Immunol Lett. 2016;172:84-88. https://doi.org/10.1016/j.imlet.2016.02.007
36. Requena-Mullor M, Alarcón-Rodríguez R, Parrón-Carreño T, Martínez-López JJ, Lozano-Paniagua D, Hernández AF. Association between Crystalline Silica Dust Exposure and Silicosis Development in Artificial Stone Workers. Int J Environ Res Public Health. 2021;18(11):5625. https://doi.org/10.3390/ijerph18115625
37. Moreira VB, Ferreira A, Gabetto JM, Marchiori E, Lourenço PM. Comparative study of high resolution computer-assisted tomography with chest radiograph in silicosis [Article in Portuguese]. Rev Port Pneumol. 2003;9(1):33-40. https://doi.org/10.1016/S0873-2159(15)30658-9
38. Bégin R, Bergeron D, Samson L, Boctor M, Cantin A. CT assessment of silicosis in exposed workers. AJR Am J Roentgenol. 1987;148(3):509-514. https://doi.org/10.2214/ajr.148.3.509
39. Bégin R, Ostiguy G, Cantin A, Bergeron D. Lung function in silica-exposed workers. A relationship to disease severity assessed by CT scan. Chest. 1988;94(3):539-545. https://doi.org/10.1378/chest.94.3.539







