ABSTRACT
Objective: To analyze the bidirectional association between wheezing and obesity during adolescence and the beginning of adulthood in a cohort in southern Brazil. Methods: This prospective longitudinal study used data from the 1993 birth cohort in Pelotas, Brazil. The following outcome variables were measured at 22 years of age: self-reported wheezing during the last 12 months and obesity (BMI = 30 kg/m2). The following exposure variables were measured at ages 11, 15, and 18: self-reported wheezing (no wheezing or symptom presentation in 1, 2, or 3 follow-ups) and obesity (non-obese or obese in 1, 2, or 3 follow-ups). Crude and adjusted logistical regression stratified by sex were used in the analyses. The reference category was defined as participants who presented no wheezing or obesity. Results: A total of 3,461 participants had data on wheezing and 3,383 on BMI. At 22 years of age, the prevalence of wheezing was 10.1% (95%CI: 9.1; 11.2), and obesity, 16.2% (95%CI: 15.0; 17.6). In females, the presence of wheezing in two follow-ups revealed a 2.22-fold (95%CI: 1.36; 3.61) greater chance of developing obesity at 22 years of age. Meanwhile, the presence of obesity in two follow-ups resulted in a 2.03-fold (95%IC: 1.05; 3.92) greater chance of wheezing at 22 years of age. No associations were found between wheezing and obesity in males. Conclusions: The obtained data suggest a possible positive bidirectional association between wheezing and obesity, with greater odds ratios in the wheezing to obesity direction in females and in the category of occurrence of exposure in two follow-ups.
Keywords:
Asthma, BMI, Respiratory Sounds, Wheezing, Body Weight.
RESUMO
Objetivo: Analisar a associação bidirecional entre sibilância e obesidade durante a adolescência e início da vida adulta em uma coorte no sul do Brasil. Métodos: Este estudo longitudinal prospectivo utilizou dados da coorte de nascimentos de 1993 em Pelotas, Brasil. As seguintes variáveis de desfecho foram medidas aos 22 anos de idade: sibilância autorreferida nos últimos 12 meses e obesidade (IMC ≥ 30 kg/m2). As seguintes variáveis de exposição foram medidas aos 11, 15 e 18 anos: sibilância autorreferida (sem sibilos ou presença do sintoma em 1, 2 ou 3 acompanhamentos) e obesidade (não obesos ou obesos em 1, 2 ou 3 acompanhamentos). Regressões logísticas simples e ajustada estratificadas por sexo foram utilizadas nas análises. A categoria de referência foi definida como participantes que não apresentavam sibilância ou obesidade. Resultados: Um total de 3.461 participantes tinham dados sobre sibilância e 3.383 sobre IMC. Aos 22 anos, a prevalência de sibilância foi de 10,1% (IC95%: 9,1; 11,2) e obesidade, 16,2% (IC95%: 15,0; 17,6). Em mulheres, a presença de sibilância em dois acompanhamentos apresentou 2,22 vezes (IC95%: 1,36; 3,61) maior chance de desenvolver obesidade aos 22 anos. Enquanto isso, a presença de obesidade em dois acompanhamentos resultou em 2,03 vezes (IC95%: 1,05; 3,92) maior chance de sibilância aos 22 anos. Não foram encontradas associações entre sibilância e obesidade em homens. Conclusões: Os dados obtidos sugerem uma possível associação bidirecional positiva entre sibilância e obesidade, com maiores razões de chance na direção sibilância para obesidade em mulheres e na categoria de ocorrência da exposição em dois acompanhamentos.
Palavras-chave:
Asma, IMC, Ruídos respiratórios, Sibilância, Peso Corporal.
INTRODUÇÃO Nos últimos anos, a literatura tem mostrado uma associação positiva entre sibilância e obesidade.(1-3) Além disso, a Global Initiative for Asthma (GINA) reitera anualmente a importância de pesquisas nessa área, uma vez que pacientes obesos asmáticos apresentam pior controle da doença e um maior ônus e frequência de sintomas, interferindo na qualidade de vida.(4)
Uma revisão sistemática propôs a possibilidade da obesidade ser um fator de risco ou modificador de efeito para o status de sibilância.(5) No entanto, a literatura é inconsistente em assumir uma direção para a associação ou a possibilidade de causas comuns entre asma e obesidade.(6,7) Para esclarecer a relação entre essas doenças e propor estratégias de manejo e prevenção, é necessário compreender a contribuição de cada doença na associação em diferentes populações com distintos aspectos socioeconômicos e ambientais.(8,4)
A análise bidirecional da associação entre sibilância e obesidade em estudos longitudinais pode ser considerada uma abordagem recente na literatura. Alguns estudos longitudinais bidirecionais(9-11) indicaram que a obesidade provavelmente precede o início da asma. Granell et al.(11) propuseram que para cada incremento de 1 kg/m2 no Índice de Massa Corporal (IMC), o risco de desenvolver asma na infância aumenta em 55%. Em contrapartida, Zhang et al.(12) verificaram que crianças diagnosticadas com asma em um determinado acompanhamento tiveram uma chance aproximadamente 40% maior de se tornarem obesas no acompanhamento subsequente. Portanto, a direcionalidade da associação entre essas doenças permanece incerta.(6,7)
Desta forma, o objetivo do presente estudo foi explorar a associação bidirecional entre sibilância e obesidade em uma coorte no sul do Brasil, investigando as associações entre a) a presença de sibilância na adolescência (11, 15 e 18 anos) e a presença de obesidade aos 22 anos e b) a presença de obesidade na adolescência (11, 15 e 18 anos) e a presença de sibilância aos 22 anos.
MÉTODOS Trata-se de um estudo longitudinal, prospectivo e de base populacional da coorte de nascimentos de 1993 em Pelotas, Brasil. Em 1993, todos os nascidos vivos cujas famílias residiam na zona urbana de Pelotas foram elegíveis para o estudo e, posteriormente, acompanhados em diferentes idades por 22 anos. As análises incluíram: a) participantes que responderam perguntas sobre sibilância nos acompanhamentos realizados aos 11, 15 e 18 anos de idade e com medidas antropométricas aos 22 anos, e b) participantes com medidas antropométricas aos 11, 15 e 18 anos de idade e com informações sobre sibilância coletadas no acompanhamento aos 22 anos. Maiores detalhes sobre a metodologia da coorte podem ser encontrados em publicações anteriores.(13-15)
Para investigar a associação bidirecional, as variáveis de interesse neste estudo foram sibilância (chiado no peito) e IMC. A variável sibilância foi definida de acordo com o “International Study of Asthma and Allergies in Childhood (ISAAC) Steering Committee”(16) e mensurada por meio de um questionário validado para a população brasileira.(17) Tratada como variável binária, os participantes foram considerados com presença de sibilância após resposta afirmativa à pergunta referente aos 12 meses que antecederam a consulta de acompanhamento: “Desde <MÊS> do ano passado, tu tiveste chiado no peito?”. A variável IMC (peso/altura2) foi dicotomizada utilizando os pontos de corte que caracterizam a presença de obesidade. Os participantes que apresentaram IMC ≥ + 2 escores z aos 11 e 15 anos e IMC ≥ 30.0 kg/m2 aos 18 e 22 anos foram considerados obesos.(18) Nos acompanhamentos aos 11 e 15 anos de idade, o peso dos participantes foi medido duas vezes usando uma balança digital (Tanita, precisão de 100 gramas), enquanto aos 18 e 22 anos, o peso foi obtido usando o sistema de rastreamento de composição corporal BOD POD® (BOD POD® Composition System; COSMED, Albano Laziale, Itália). A altura dos participantes foi medida com um estadiômetro.
Para a análise bidirecional, foram utilizadas as seguintes combinações: a) presença de sibilos aos 11, 15 e 18 anos como exposição e “obesidade aos 22 anos” como desfecho, e b) obesidade aos 11, 15 e 18 anos como exposição e “sibilos no acompanhamento aos 22 anos” como desfecho. As variáveis de exposição foram geradas para a presença de sibilância e obesidade e foram categorizadas da seguinte forma: ausência de exposição nos três acompanhamentos, um acompanhamento (presença de exposição em um dos três acompanhamentos); dois acompanhamentos (presença de exposição em dois dos três acompanhamentos); sempre apresentando a exposição (presença de exposição nas três visitas de acompanhamento).
As covariáveis coletadas no acompanhamento perinatal foram: sexo (masculino/feminino), cor da pele (branca/preta/outra), peso ao nascer (gramas), idade gestacional ao nascer (semanas), escolaridade materna durante a gestação (anos), tabagismo materno durante a gestação (sim/não), história familiar (pai e/ou mãe) de asma (sim/não) e renda familiar (salários mínimos). No acompanhamento aos 11 anos, as covariáveis de interesse foram: renda familiar (em Reais) e tabagismo parental (nunca/ex-fumante/fumante). Para caracterizar a amostra no acompanhamento aos 22 anos, foram avaliadas as seguintes covariáveis: escolaridade (anos), índice de bens (quintis), tabagismo (nunca fumou/ex-fumante/fumante), atividade física total (lazer e deslocamento) ≥ 150 min/semana (sim/não) e uso de corticoides nos últimos três meses (sim/não).
As variáveis categóricas foram descritas como frequências relativas e os respectivos intervalos de confiança de 95% (IC95%). De acordo com as variáveis do acompanhamento perinatal, o teste do qui-quadrado de Pearson foi usado para comparar a amostra da coorte original e as amostras incluídas nas análises. As prevalências de obesidade e sibilância aos 22 anos foram descritas de acordo com as variáveis demográficas, socioeconômicas, comportamentais e de saúde, e foi utilizado o teste do qui-quadrado de Pearson ou o teste do qui-quadrado para tendências lineares de acordo com as variáveis independentes.
Para testar a associação simples e ajustada entre os desfechos sibilância e obesidade aos 22 anos de idade de acordo com a exposição (obesidade e sibilância dos 11 aos 18 anos, respectivamente), foram utilizadas regressões logísticas estratificadas por sexo, independentemente da significância do teste de interação. As variáveis de confusão foram determinadas a priori e incluídas simultaneamente nos modelos analíticos. Elas foram definidas como: cor da pele, peso ao nascer, idade gestacional, escolaridade materna durante a gestação, tabagismo materno durante a gestação, história familiar de asma, renda familiar e tabagismo parental no acompanhamento aos 11 anos. O valor-p das análises de associação foi dado pelo Teste de Wald. Adotou-se um nível de significância de 5% e as análises foram realizadas no software Stata 16.0 (Stata Corp. LP, College Station, TX, EUA).
Os acompanhamentos da coorte de 1993 foram aprovados pelo Comitê de Ética da Universidade Federal de Pelotas, sendo o protocolo mais recente o de nº 1.250.366, aos 22 anos. Todos os participantes ou responsáveis foram informados sobre os objetivos do estudo e assinaram um termo de consentimento livre e esclarecido antes do início da coleta de dados, de acordo com a Declaração de Helsinque.
RESULTADOS A coorte de 1993 é composta por 5.249 nascidos vivos, com taxas de acompanhamento de 87,5%, 85,7%, 81,4% e 76,3% aos 11, 15, 18 e 22 anos, respectivamente. Foram incluídos neste estudo 3.461 participantes com informações completas sobre sibilância dos 11 a 18 anos de idade e 3.383 participantes com dados sobre IMC dos 11 a 18 anos. Não foram observadas diferenças na distribuição das características perinatais entre a amostra da coorte original e as amostras incluídas nas análises (Tabela 1).

As prevalências de obesidade e sibilância nos últimos 12 meses no acompanhamento aos 22 anos segundo variáveis demográficas, socioeconômicas, comportamentais e de saúde estão apresentadas na Tabela 2. A prevalência de obesidade foi de 16,2% (IC95%: 15,0; 17.6). As maiores prevalências de obesidade, com significância estatística, foram observadas em participantes do sexo feminino em oposição aos do sexo masculino (18,5% versus 13,7%), cor da pele preta (19,1% versus 15,1% com cor da pele branca), história familiar de asma (18,6% versus 15,1% sem história familiar) e participantes cujos pais eram ex-fumantes no acompanhamento aos 11 anos de idade (17,9% versus 13,5% naqueles cujos pais eram não fumantes). A prevalência de obesidade foi de 17,9% no quintil mais pobre do índice de bens aos 22 anos, enquanto no quintil mais rico foi de 10,8%. Além disso, os participantes com 12 ou mais anos de estudo apresentaram menor prevalência de obesidade (12,1%) quando comparados às demais categorias.

A prevalência de sibilância nos últimos 12 meses foi de 10,1% (IC95%: 9,1; 11,2). As maiores prevalências de sibilância, com significância estatística, foram observadas em participantes cujas mães tinham menor escolaridade (11,9% versus 8,9% das mães com mais anos de estudo), fumaram durante a gravidez (12,1% versus 9,2% nas não fumantes), e em participantes com história parental de asma (14,7% versus 7,8% sem história parental de asma). Em relação às variáveis referentes aos próprios participantes, foi encontrada uma maior prevalência de sibilância aos 22 anos naqueles participantes com menos anos de estudo (18,3% versus 8% com mais anos de estudo), no quintil mais pobre em relação ao dos mais ricos (12,9% versus 7,7%), entre os fumantes (20,1% versus 7,7% nos não fumantes), entre os obesos (14% versus 9,5% nos não obesos) e entre os que relataram o uso de corticoides nos últimos três meses em relação aos que não faziam uso desses medicamentos (19,3% versus 8,5%) (Tabela 2).
Durante o período dos 11 aos 18 anos, foram realizados três acompanhamentos na coorte de nascimentos de 1993. Enquanto a prevalência geral de sibilância em pelo menos uma das consultas de acompanhamento foi de 23,2% (IC95%: 21,8; 24,6), 2,4% (IC95%: 1,9; 2,9) sempre relataram a presença do sintoma. Quanto à obesidade, a prevalência geral em pelo menos um acompanhamento foi de 11,4% (IC95%: 10,3; 12,5) e 3,7% (IC95%: 3,2; 4,4) eram obesos em todos os acompanhamentos. Na estratificação por sexo, a prevalência de obesidade nas duas categorias supracitadas foi maior em homens (13,8% e 4,7%, respectivamente). O mesmo não foi observado entre as mulheres (Figura 1).

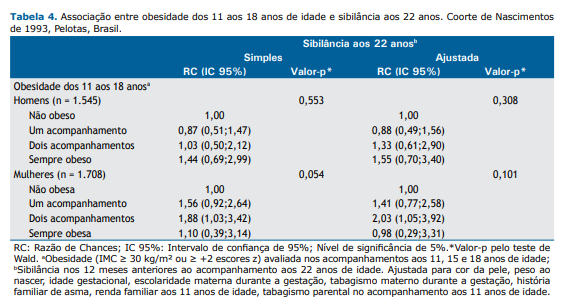
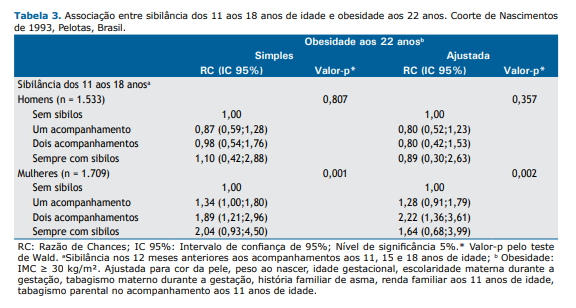
A associação entre a presença de sibilância dos 11 aos 18 anos de idade e obesidade aos 22 anos de acordo com o sexo pode ser observada na Tabela 3. Não houve associação entre sibilância e obesidade em homens. Por outro lado, nas mulheres, a presença de sibilância dos 11 aos 18 anos foi positivamente associada a obesidade aos 22 anos na análise simples. Posteriormente, nas análises ajustadas, a categoria sibilância em dois acompanhamentos manteve essa associação com um IC95% que não incluiu a referência. As mulheres que apresentaram sibilância em dois acompanhamentos tiveram 2,22 vezes (IC95%: 1,36; 3,61) mais chances de desenvolver obesidade aos 22 anos quando comparadas às participantes que não apresentaram sibilância (p = 0,002).
Na Tabela 4, observamos uma associação entre obesidade dos 11 aos 18 anos e a presença de sibilância aos 22 anos de acordo com o sexo. Não foram observadas associações para o sexo masculino. Em mulheres, a presença de obesidade em dois acompanhamentos foi positivamente associada a presença de sibilância autorrelatada aos 22 anos, embora sem significância estatística. As participantes do sexo feminino também tiveram 2,03 vezes (IC95%: 1,05; 3,92) maiores chances de desenvolver sibilância aos 22 anos do que aquelas que não apresentaram obesidade nos acompanhamentos de interesse (p = 0,101).
DISCUSSÃO O objetivo deste estudo foi analisar a associação bidirecional entre sibilância e obesidade na adolescência e no início da idade adulta. De acordo com nossas análises, aproximadamente um terço dos participantes apresentou sibilância em pelo menos um dos acompanhamentos na adolescência e cerca de 10% apresentou sibilância no início da idade adulta. Por outro lado, cerca de um quinto dos participantes foram classificados como obesos em pelo menos um acompanhamento entre 11 e 18 anos e cerca de 16% eram obesos aos 22 anos. Além disso, uma associação bidirecional positiva entre sibilância e obesidade foi observada mesmo após ajuste para variáveis de confusão. Nas participantes do sexo feminino, a presença de sibilância autorreferida em dois acompanhamentos entre 11 e 18 anos aumentou a chance de ser obesa aos 22 anos. Por sua vez, a presença de obesidade em dois acompanhamentos aumentou as chances de participantes do sexo feminino de apresentarem sibilância aos 22 anos de idade.
Ao analisar a distribuição das variáveis demográficas, socioeconômicas, comportamentais e de saúde em participantes que apresentavam sibilância ou obesidade aos 22 anos, observaram-se desigualdades demográficas e sociais. Houve uma maior prevalência dos desfechos entre os participantes com menor escolaridade, que pertenciam aos quintis mais pobres do índice de bens e que eram de cor de pele preta. Malta et al.(19) relataram resultados semelhantes ao analisar as desigualdades socioeconômicas na prevalência de doenças crônicas não transmissíveis em adultos brasileiros usando dados da Pesquisa Nacional de Saúde de 2019, reforçando a importância de monitorar indicadores de desigualdade em saúde e implementar políticas públicas que abordem essa questão.
Em relação às variáveis comportamentais, as maiores prevalências de sibilância ou obesidade aos 22 anos estiveram atreladas às categorias de exposição ao tabagismo. Vários estudos demonstraram associações positivas entre a exposição ao tabagismo e obesidade ou sibilância.(20,21) Uma meta-análise envolvendo 79 estudos mostrou que a exposição ao tabagismo durante a gravidez ou no período pós-natal (pai, mãe ou familiar) aumentou o risco de sibilância na infância e adolescência.(21)
Um documento contendo estratégias globais para o manejo e prevenção da asma (GINA) sugere a possibilidade de um fenótipo para asma, conhecido como “asma com obesidade”, uma vez que indivíduos obesos asmáticos apresentam sintomas respiratórios mais graves e maior dificuldade no controle da doença.(4) Nossos resultados mostraram que a maior prevalência de obesidade foi entre os participantes que relataram sibilância nos últimos 12 meses e que tinham história familiar de asma. Além disso, houve maior prevalência de sibilância nos participantes obesos quando comparados aos não obesos.
A literatura mostra uma possível associação positiva entre asma e obesidade, embora principalmente em estudos transversais,(1,22,23) que são sujeitos a viés de causalidade reversa. Estudos longitudinais são necessários para verificar a direção da associação;(3,10,24) no entanto, poucos estudos documentam a associação bidirecional, indicando que essa abordagem precisa ser mais explorada.(9-12,25)
No presente estudo, verificamos que a presença de sibilância em dois acompanhamentos aumentou a chance de ser obeso aos 22 anos de idade em aproximadamente 120% quando comparado aos participantes sem sibilância (Tabela 3, mulheres). Zhang et al.(12) também observaram que crianças diagnosticadas com asma em um determinado acompanhamento tiveram 1,38 vezes (IC95%: 1,12; 1,71) mais chances de se tornarem obesas no acompanhamento subsequente de seu estudo quando comparadas a crianças sem asma. A literatura é incerta quanto aos possíveis mecanismos causais associados a exposição à asma e a incidência de obesidade. Em geral, as hipóteses apontam para atividade física reduzida,(26) o uso contínuo de medicação para controle da asma,(27) um potencial distúrbio metabólico relacionado a resistência à insulina e leptina(28) e exposição ao tabagismo.(29) Ressalta-se que existem possíveis fatores genéticos comuns a ambas as doenças associados a genes com efeitos pleiotrópicos, como receptores β2-adrenérgicos (ADRB2), vitamina D (VDR), leptina (LEP), proteína quinase C alfa (PRKCA) e fator de necrose tumoral alfa (TNFα).(30)
Nossos resultados também mostraram que a obesidade aumenta a chance de ocorrência de sibilância e são corroborados pelos estudos longitudinais bidirecionais com randomização mendeliana de Granell et al.(11) e Xu et al.,(9) que verificaram que para cada aumento de 1 a 4,8 kg/m2 no IMC, os indivíduos apresentaram de 1,18 (IC95%: 1,11; 1,25) a 1,55 (IC95%: 1,16; 2,07) vezes maior risco de desenvolver asma. Em geral, a direção da associação da obesidade para asma é mais estudada e descrita na literatura. Contudo, os mecanismos relacionados à plausibilidade da associação não estão bem definidos, mas a literatura aponta a inflamação sistêmica da obesidade como um fator causal para a inflamação das vias respiratórias e, consequentemente, sibilância. Em outras palavras, os adipócitos seriam uma possível fonte de citocinas pró-inflamatórias.(31)
Na mesma população incluída neste estudo, aos 11 e 15 anos, Noal et al.(2) verificaram que o risco de sibilância persistente foi 80% maior em adolescentes obesos quando comparados aos eutróficos aos 11 anos, assim como entre aqueles que estavam no tercil superior da soma das dobras cutâneas. Na faixa de 18 a 22 anos, Menezes et al.(3) relataram que indivíduos obesos tinham 2 vezes (IC95%: 1,32; 3,03) mais chances de desenvolver sibilância aos 22 anos. As idades avaliadas anteriormente nesta mesma coorte referiam-se apenas a dois acompanhamentos (11 e 15 anos no estudo de Noal e 18 e 22 anos no de Menezes); é possível que a bidirecionalidade observada no presente estudo se deva ao maior período de análise (11, 15, 18 e 22 anos).
Em um estudo prospectivo de base populacional realizado com adolescentes e jovens adultos na Noruega, Egan et al.(25) também encontraram uma possível associação bidirecional positiva entre asma e obesidade. No entanto, foi significativa apenas para o sexo masculino, em que os adolescentes que apresentaram obesidade tiveram 1,80 vezes (IC95%: 1,02; 3,18) mais chances de diagnóstico ou sintomas de asma autorreferidos em 11 anos de acompanhamento, e os adolescentes que relataram sintomas ou diagnóstico de asma tiveram 1,90 vezes (IC95%: 1,12; 3,24) mais chances de desenvolver obesidade. Em nosso estudo, apesar de observarmos uma associação estatisticamente significativa entre sibilância e obesidade apenas nos participantes do sexo feminino, não é possível inferir que o sexo seja um modificador de efeito da associação devido a falta de significância, o que pode estar relacionado ao tamanho amostral das categorias de exposição e o poder da análise para o sexo masculino; outro ponto é que os homens têm uma porcentagem de tecido adiposo menor do que as mulheres, fato que pode distorcer a medida do efeito para um efeito nulo. Corroborando nossos achados, uma meta-análise de estudos longitudinais prospectivos realizada por Beuther et al.(32) sobre sobrepeso, obesidade e incidência de asma mostrou que a associação não foi modificada pelo sexo.
Ao analisar as medidas de efeito entre as categorias de exposição para sibilância e obesidade dos 11 aos 18 anos, em alguns casos houve aumento nos valores de medida de efeito à medida que a exposição aumentava. No entanto, não é possível afirmar que houve efeitos dose-resposta em todas as associações testadas. Entretanto, uma meta-análise de estudos longitudinais mostrou que a incidência de asma aumentou em torno de 50% quando os indivíduos apresentavam sobrepeso/obesidade com efeitos dose-resposta.(32)
Algumas limitações podem ser apontadas neste estudo, como a utilização do sintoma sibilância como “proxy” para o diagnóstico de asma; entretanto, em estudos epidemiológicos com amostras grandes, essa medida é comumente utilizada.(16) É possível que a sibilância nos últimos 12 meses esteja sujeita a viés de informação; no entanto, a subestimação consequente não teria um efeito substancial. (17) De acordo com o estudo SAPALDIA (Swiss Study on Air Pollution and Lung Diseases in Adults), os sintomas respiratórios são preditores confiáveis de asma; a sibilância como único sintoma apresentou a melhor sensibilidade (74,7%), valor preditivo negativo (99,3%) e índice de Youden (0,62). Quanto às combinações de sintomas, a associação da sibilância com dois dos três sintomas (dispneia noturna, aperto no peito e tosse) foi a melhor ferramenta para o diagnóstico de asma.(33) Além disso, os períodos entre os acompanhamentos (aproximadamente 3 anos) e o tempo de avaliação das variáveis (sibilos nos últimos 12 meses e IMC no momento da coleta de dados) estão sujeitos a flutuações nos desfechos, podendo haver perda de algumas informações; portanto, não é possível afirmar que as medidas de ocorrência e efeito não foram subestimadas.
Por outro lado, pontos fortes deste estudo incluem o desenho prospectivo de 22 anos de acompanhamento em uma amostra de base populacional. O período de acompanhamento prolongado permite observar o efeito cumulativo das exposições sobre os desfechos estudados. As altas taxas de acompanhamento, sendo a menor aos 22 anos (aproximadamente 75%), reduzem a possibilidade de viés de seleção, confirmado pelos resultados da Tabela 1.
Em conclusão, o presente estudo demonstrou uma possível associação bidirecional positiva entre sibilância e obesidade, com maiores valores de medida de efeito na direção sibilância para obesidade, mesmo após ajustes para fatores de confusão. Tal associação parece ser mais evidente no sexo feminino e para a categoria presença de sibilância/obesidade em dois acompanhamentos na adolescência. Estudos futuros devem avaliar se existem pontos críticos para idades específicas que levam aos desfechos, para esclarecer os aspectos ainda obscuros da associação sibilância/obesidade.
REFERÊNCIAS 1. Lu KD, Billimek J, Bar-Yoseph R, Radom-Aizik S, Cooper DM, Anton-Culver H. Sex differences in the relationship between fitness and obesity on risk for asthma in adolescents. J Pediatr. 2016;176:36-42. https://doi.org/10.1016/j.jpeds.2016.05.050. PMCID: PMC5003726.
2. Noal RB, Menezes AM, Macedo SE, Dumith SC, Perez-Padilla R, Araújo CL, et al. Is obesity a risk factor for wheezing among adolescents? A prospective study in southern Brazil. J Adolesc Health. 2012;51(6):S38-S45. https://doi.org/10.1016/j.jadohealth.2012.08.016. PMCID: PMC3500686.
3. Menezes AMB, de Oliveira PD, Blumenberg C, Sanchez-Angarita E, Niño-Cruz GI, Zabert I, et al. Longitudinal association of adiposity with wheezing and atopy at 22 years: the 1993 Birth Cohort, Pelotas, Brazil. J Asthma Allergy. 2018;11:283-291. https://doi.org/10.2147/JAA.S183699. PMID: 30555245.
4. Global Initiative for Asthma. Global Strategy for Asthma Management and Prevention. 2022: 1-225. Available from: www.ginasthma.org. Accessed on: 05/18/2022.
5. Deng X, Ma J, Yuan Y, Zhang Z, Niu W. Association between overweight or obesity and the risk for childhood asthma and wheeze: An updated meta-analysis on 18 articles and 73 252 children. Pediatr Obes. 2019;14(9):e12532. https://doi.org/10.1111/ijpo.12532. PMID: 31033249.
6. Miethe S, Karsonova A, Karaulov A, Renz H. Obesity and asthma. J Allergy Clin Immunol. 2020;146(4):685-693. https://doi.org/10.1016/j.jaci.2020.08.011. PMID: 33032723.
7. Lang JE. Obesity and childhood asthma. Curr Opin Pulm Med. 2019;25(1):34-43. https://doi.org/10.1097/MCP.0000000000000537. PMID: 33032723.
8. Pavord ID, Beasley R, Agusti A, Anderson GP, Bel E, Brusselle G, et al. After asthma: redefining airways diseases. Lancet. 2018;391(10118):350-400. https://doi.org/10.1016/S0140-6736(17)30879-6. Epub 2017 Sep 11. PMID: 28911920.
9. Xu S, Gilliland FD, Conti DV. Elucidation of causal direction between asthma and obesity: a bi-directional Mendelian randomization study. Int J Epidemiol. 2019;48(3):899-907. https://doi.org/10.1093/ije/dyz070. PMID: 31005996.
10. Chen YC, Fan HY, Huang YT, Huang SY, Liou TH, Lee YL. Causal relationships between adiposity and childhood asthma: bi-directional Mendelian Randomization analysis. Int J Obes (Lond). 2019;43(1):73-81. https://doi.org/10.1038/s41366-018-0160-8. PMID: 30026589.
11. Granell R, Henderson AJ, Evans DM, Smith GD, Ness AR, Lewis S, et al. Effects of BMI, fat mass, and lean mass on asthma in childhood: a Mendelian randomization study. PLoS Med. 2014;11(7):e1001669. https://doi.org/10.1371/journal.pmed.1001669. PMID: 24983943.
12. Zhang Y, Chen Z, Berhane K, Urman R, Chatzi VL, Breton C, et al. The dynamic relationship between asthma and obesity in schoolchildren. Am J Epidemiol. 2020;189(6):583-591. https://doi.org/10.1093/aje/kwz257. PMID: 31712801.
13. Victora CG, Barros FC, Halpern R, Menezes AMB, Horta BL, Tomasi E, et al. Longitudinal study of the mother and child population in an urban region of southern Brazil, 1993: methodological aspects and preliminary results. Rev Saude Publica. 1996;30(1):34-45. https://doi.org/10.1590/S0034-89101996000100005.
14. Gonçalves H, Assunção MC, Wehrmeister FC, Oliveira IO, Barros FC, Victora CG, et al. Cohort profile update: The 1993 Pelotas (Brazil) birth cohort follow-up visits in adolescence. Int J Epidemiol. 2014;43(4):1082-8. https://doi.org/10.1093/ije/dyu077. PMID: 24729426.
15. Gonçalves H, Wehrmeister FC, Assunção MCF, Tovo-Rodrigues L, Oliveira IO, Murray J, et al. Cohort Profile Update: The 1993 Pelotas (Brazil) Birth Cohort follow-up at 22 years. Int J Epidemiol. 2018;47(5):1389-1390e. https://doi.org/10.1093/ije/dyx249. PMID: 29240909.
16. Asher MI, Weiland SK. The International Study of Asthma and Allergies in Childhood (ISAAC). ISAAC Steering Committee. Clin Exp Allergy. 1998;28(5):52-66. https://doi.org/10.1046/j.1365-2222.1998.028s5052.x. PMID: 9988448.
17. Solé D, Vanna AT, Yamada E, Rizzo MC, Naspitz CK. International Study of Asthma and Allergies in Childhood (ISAAC) written questionnaire: validation of the asthma component among Brazilian children. J Investig Allergol Clin Immunol. 1998;8(6):376-382. PMID: 10028486.
18. Ayvas G, Çimen AR. Methods for body composition analysis in adults. The Open Obesity Journal. 2011; 3:62-9. https://doi.org/10.2174/1876823701103010062.
19. Malta DC, Bernal RTI, Lima MG, Silva AGD, Szwarcwald CL, Barros MBA. Socioeconomic inequalities related to noncommunicable diseases and their limitations: National Health Survey, 2019. Rev Bras Epidemiol. 2021;24(2):e210011. https://doi.org/10.1590/1980-549720210011.supl.2. PMID: 34910065.
20. Poorolajal J, Sahraei F, Mohamdadi Y, Doosti-Irani A, Moradi L. Behavioral factors influencing childhood obesity: a systematic review and meta-analysis. Obes Res Clin Pract. 2020;14(2):109-118. https://doi.org/10.1016/j.orcp.2020.03.002. PMID: 32199860.
21. Burke H, Leonardi-Bee J, Hashim A, Pine-Abata H, Chen Y, Cook DG, et al. Prenatal and passive smoke exposure and incidence of asthma and wheeze: systematic review and meta-analysis. Pediatrics. 2012;129(4):735-44. https://doi.org/10.1542/peds.2011-2196. PMID: 22430451.
22. Forno E, Han YY, Libman IM, Muzumdar RH, Celedón JC. Adiposity and asthma in a nationwide study of children and adults in the United States. Ann Am Thorac Soc. 2018;15(3):322-330. https://doi.org/10.1513/AnnalsATS.201709-723OC. PMID: 29144884.
23. Myung J, Lee H, Kim TH, Han E. Relationships between self-reported asthma and pulmonary function and various measures of obesity. J Asthma. 2018;55(7):741-749. https://doi.org/10.1080/02770903.2017.1362701. PMID: 28800274.
24. Lang JE, Bunnell HT, Hossain MJ, Wysocki T, Lima JJ, Finkel TH, et al. Being overweight or obese and the development of asthma. Pediatrics. 2018;142(6):e20182119. https://doi.org/10.1542/peds.2018-2119. PMID: 30478238.
25. Egan KB, Ettinger AS, DeWan AT, Holford TR, Holmen TL, Bracken MB. Longitudinal associations between asthma and general and abdominal weight status among Norwegian adolescents and young adults: the HUNT Study. Pediatr Obes. 2015;10(5):345-52. https://doi.org/10.1111/ijpo.271. PMID: 25405952.
26. Ritz T, Rosenfield D, Steptoe A. Physical activity, lung function, and shortness of breath in the daily life of individuals with asthma. Chest. 2010;138(4):913-8. https://doi.org/10.1378/chest.08-3073. PMID: 20472861.
27. Schwarzer G, Bassler D, Mitra A, Ducharme FM, Forster J. Ketotifen alone or as additional medication for long-term control of asthma and wheeze in children. Cochrane Database Syst Rev. 2004;2004(1):CD001384. https://doi.org/10.1002/14651858.CD001384.pub2. PMID: 14973969.
28. Arshi M, Cardinal J, Hill RJ, Davies PS, Wainwright C. Asthma and insulin resistance in children. Respirology. 2010;15(5):779-84. https://doi.org/10.1111/j.1440-1843.2010.01767.x. PMID: 20456670.
29. Riedel C, Schönberger K, Yang S, Koshy G, Chen YC, Gopinath B, et al. Parental smoking and childhood obesity: higher effect estimates for maternal smoking in pregnancy compared with paternal smoking—a meta-analysis. Int J Epidemiol. 2014;43(5):1593-606. https://doi.org/10.1093/ije/dyu150. PMID: 25080528.
30. Danielewicz H. What the genetic background of individuals with asthma and obesity can reveal: is b2-adrenergic receptor gene polymorphism important? Pediatr Allergy Immunol Pulmonol. 2014;27(3):104-10. https://doi.org/10.1089/ped.2014.0360. PMID: 25276484.
31. Fantuzzi G. Adipose tissue, adipokines, and inflammation. J Allergy Clin Immunol. 2005;115(5):911-9. https://doi.org/10.1016/j.jaci.2005.02.023. PMID: 15867843.
32. Beuther DA, Sutherland ER. Overweight, obesity, and incident asthma: a meta-analysis of prospective epidemiologic studies. Am J Respir Crit Care Med. 2007;175(7):661-6. https://doi.org/10.1164/rccm.200611-1717OC. PMID: 17234901.
33. Sistek D, Tschopp JM, Schindler C, Brutsche M, Ackermann-Liebrich U, Perruchoud AP, et al. Clinical diagnosis of current asthma: predictive value of respiratory symptoms in the SAPALDIA study. Swiss Study on Air Pollution and Lung Diseases in Adults. Eur Respir J. 2001;17(2):214-9. https://doi.org/10.1183/09031936.01.1720214. PMID: 11334122.