ABSTRACT
Objective: To compare gastric lavage (GL) performed in inpatients with GL performed in outpatients in terms of its accuracy in diagnosing
pulmonary tuberculosis (TB) in children. Methods: A prospective study was carried out in the state of Espírito Santo, Brazil, from 1999 to 2003.
A total of 230 children suspected of having TB (103 inpatients and 127 outpatients) were selected to undergo GL. Those thus diagnosed with
TB (n = 53) were divided into two groups: inpatient GL (n = 30) and outpatient GL (n = 23). All 53 children were monitored for 6 months in
order to evaluate the accuracy of the diagnosis. Accuracy was determined based on any change in diagnosis, cure rate, and the percentage
of positive cultures in the two groups studied. Results: The cure rate was 100% in both groups, and there was no change in diagnosis in the
53 children studied. No significant difference was found between the two groups studied in terms of detection of Mycobacterium tuberculosis
(RR = 1.47; 95% CI: 0.95-2.27; p = 0.095), although the outpatient group presented a greater rate of positive cultures. Conclusions: Our results
show that the accuracy of GL performed in an inpatient setting is similar to that of GL performed in an outpatient setting. This indicates that
hospitalization is required only in more severe cases in which GL cannot be performed as an outpatient procedure.
Keywords:
Gastric lavage; Tuberculosis; Diagnosis.
RESUMO
Objetivo: Comparar a acurácia do lavado gástrico (LG) realizado em ambiente hospitalar e ambulatorial no diagnóstico da tuberculose (TB)
pulmonar em crianças. Métodos: Estudo prospectivo realizado no Estado do Espírito Santo, Brasil, de 1999 a 2003. Um total de 230 crianças
com suspeita de TB foi selecionado para realizar exame de LG em ambiente hospitalar (n = 103) ou em ambiente ambulatorial (n = 127).
Desse total, 53 foram diagnosticadas como casos de TB e divididas em dois grupos: LG hospitalar (n = 30) e LG ambulatorial (n = 23). Todas
as 53 crianças foram monitoradas por 6 meses para avaliação da acurácia do diagnóstico. A acurácia foi determinada com base na mudança
do diagnóstico, na taxa de cura e no percentual de culturas positivas nos dois grupos estudados. Resultados: A taxa de cura foi de 100%
nos dois grupos, e não houve mudança de diagnóstico nas 53 crianças estudadas. Nenhuma diferença significativa foi encontrada entre os
dois grupos estudados em relação ao achado do Mycobacterium tuberculosis (RR = 1,47; IC95%: 0,95-2,27; p = 0,095), apesar de o grupo
LG ambulatorial ter apresentado o maior índice de cultura positivas. Conclusões: Nossos resultados mostram que a acurácia do LG realizado
em ambiente hospitalar é semelhante à do realizado em ambiente ambulatorial, o que indica que a internação é necessária apenas em casos
mais graves nos quais não se pode realizar o procedimento em ambiente ambulatorial.
Palavras-chave:
Lavagem gástrica; Tuberculose; Diagnóstico.
IntroduçãoNo mundo, a tuberculose (TB) é a segunda causa de morte por doenças transmissíveis, matando cerca de 2 milhões de pessoas a cada ano. Estima-se que aproximadamente 2 bilhões de pessoas, ou um terço da população mundial, estejam infectadas pelo Mycobacterium tuberculosis (Mtb), e que aproximadamente 10% dessas pessoas irão desenvolver TB ativa.(1)
Entre as crianças dos países em desenvolvimento, a TB é responsável por 1,3 milhão de casos novos e por 450.000 mortes ao ano.(2) No Brasil, 15% de todos os casos de TB relatados ocorrem em pacientes pediátricos com menos de 15 anos.(3,4)
Os programas de controle da TB são voltados quase que exclusivamente para os adultos com TB confirmada por baciloscopia de escarro, uma vez que eles são indivíduos altamente infecciosos. Entretanto, as crianças representam uma parcela significativa da carga global de casos de TB e experimentam consideráveis efeitos relacionados à TB (morbidade e mortalidade).(5)
Além disso, as crianças mostraram ter um papel importante na cadeia de transmissão da TB, não como uma fonte ativa de doença para seus contatos domiciliares, mas como importantes reservatórios de Mtb. Os bacilos podem sobreviver em estado latente por muitos anos em crianças, as quais, em alguns casos, mais tarde desevolvem TB ativa. Assim, a TB na infância é considerada um importante indicador de sucesso dos programas de saúde pública em interromper e evitar a transmissão da TB.(6)
Os sinais e os sintomas da TB em crianças são inespecíficos, o que torna difícil o diagnóstico clínico, atrasando o tratamento e a prevenção. A TB na infância apresenta um amplo espectro clínico, o qual varia desde formas assintomáticas até formas disseminadas mais graves, sendo tipicamente acompanhada por caquexia e freqüentemente levando à morte.(7)
É difícil confirmar o diagnóstico de TB utilizando-se os métodos atualmente disponíveis. Mesmo em países industrializados, a tríade obtenção de teste tuberculínico (TT) positivo/identificação de manifestações radiológicas ou clínicas compatíveis com TB/estabelecimento de ligação recente com um caso conhecido de TB infecciosa constitui o "padrão ouro" para o diagnóstico. Mesmo quando esses critérios são preenchidos, freqüentemente surgem problemas relacionados à confirmação bacteriológica.(5)
Como as crianças com TB pulmonar não conseguem produzir escarro, o lavado gástrico (LG) é atualmente o procedimento de escolha para a confirmação microbiológica de doença tuberculosa. Embora o procedimento para realização do LG tenha sido descrito em vários estudos, há variações acentuadas quanto ao volume de solução salina utilizado, o número de amostras coletadas por paciente e o manejo dos pacientes com resultados negativos. Portanto, não há consenso quanto ao protocolo para a realização do LG, e sua sensibilidade é baixa (variando de 30 a 40%). Os resultados da cultura podem levar semanas, e os esfregaços podem produzir resultados falso-positivos, o que torna difícil a comparação entre os estudos.(5,6,8-10)
A baciloscopia positiva para bacilos álcool-ácido resistentes pode ser um critério para o início do tratamento. Entretanto, o procedimento para a coleta de amostras, a concentração de bacilos em uma dada amostra (amostra paubacilar) e a necessidade de internação dos pacientes para a coleta das amostras tornaram-se um problema, especialmente em países em desenvolvimento, onde leitos hospitalares são escassos.
Em um estudo retrospectivo, a cultura do Mtb em aspirados gástricos coletados de crianças em ambiente ambulatorial mostrou ter um rendimento comparável ao dos aspirados coletados de crianças internadas, sugerindo que a internação pode não ser necessária para o diagnóstico da TB na infância.(11)
O objetivo do presente estudo foi comparar, prospectivamente, o LG pediátrico hospitalar e o ambulatorial quanto ao rendimento dos aspirados gástricos coletados para a cultura do Mtb, e também quanto à sua acurácia no diagnóstico da TB pulmonar. Além disso, tentamos identificar os fatores associados à cultura positiva.
MétodosTrata-se de um estudo prospectivo, com quatro anos de duração, envolvendo todos os cases suspeitos de TB tratados em dois hospitais infantis do estado do Espírito Santo, Brasil.
O estudo foi realizado entre julho de 1999 e agosto de 2003. Nesse período, um total de 230 crianças com menos de 15 anos de idade foi encaminhado aos dois hospitais para investigação de TB. Desde 1999, no estado do Espírito Santo, há um sistema centralizado de distribuição de leitos hospitalares conhecido como "Central de Vagas", o qual é responsável por encaminhar crianças a vários hospitais. Nós usamos esse sistema para selecionar aleatoriamente as crianças com base no hospital ao qual elas foram encaminhadas.
O único critério de exclusão foi ser HIV-positivo. Os critérios de inclusão foram história de contato com um caso-índice, sinais e sintomas compatíveis com TB, TT positivo e achados radiológicos sugestivos de TB. Os dados clínicos foram obtidos por meio de exames físicos realizados por médicos treinados.
As informações relacionadas à história de doença (tosse, febre, contato com um caso-índice de TB, vacinação com bacilo de Calmette-Guérin-BCG-e desnutrição) foram obtidas com os pais.
Usou-se o derivado protéico purificado RT-23. A execução dos TTs e a interpretação dos resultados dos TTs foram conduzidas de acordo com as diretrizes do Ministério da Saúde do Brasil para o diagnóstico da TB na infância (Quadro 1).(12)

Os achados radiológicos foram considerados suspeitos quando pelo menos um dos seguintes padrões foi encontrado: linfonodomegalia hilar à direita, infiltração, cavitação, atelectasia e padrão miliar.(13)
Das 230 crianças com suspeita de TB, 103 foram encaminhadas ao Hospital Infantil Nossa Senhora da Glória (HINSG) para a realização de LG em ambiente hospitalar, e 127 foram encaminhadas ao Hospital Universitário Cassiano Antônio Moraes (HUCAM) para a realização de LG em ambiente ambulatorial.
Das 230 crianças primeiramente incluídas neste estudo, 54 foram clinicamente diagnosticadas com TB. Entretanto, um paciente agendado para a realização de LG em ambiente hospitalar foi excluído por ser HIV-positivo. As 53 crianças restantes foram divididas em dois grupos: as que foram submetidas ao LG no HINSG (grupo hospitalar; n = 30) e as que foram submetidas ao LG no HUCAM (grupo ambulatorial; n = 23). Todas as 53 crianças foram acompanhadas por 6 meses para a avaliação da acurácia do diagnóstico. A acurácia foi estimada levando-se em consideração qualquer mudança no diagnóstico, a taxa de cura e a porcentagem de culturas positivas nos dois grupos.
A amostragem foi realizada nos dois locais de estudo (o HUCAM e o HINSG). Foi necessário que as crianças permanecessem em jejum por 8 h antes da realização do LG. As crianças submetidas ao LG hospitalar foram internadas na ala pediátrica. Um cateter nasofaríngeo foi introduzido à meia-noite, e o LG foi realizado às 7:00 da manhã por uma infermeira registrada. O procedimento foi repetido em 3 dias consecutivos. O LG ambulatorial também foi realizado em 3 dias consecutivos seguindo um protocolo idêntico ao descrito acima. Foi necessário que os pacientes permanecessem em jejum por 8 h antes da realização do LG e comparecessem ao ambulatório do HUCAM às 7:00 da manhã. Os pais receberam vales-transporte. Todos os procedimentos ambulatoriais foram realizados por duas enfermeiras registradas.
Nos testes laboratoriais, a coloração de esfregaços e a cultura em meio sólido foram utilizadas para identificar o Mtb. As amostras de esfregaço foram processadas de acordo com o protocolo padrão para a pesquisa de bacilos álcool-ácido resistentes pelo método de Ziehl-Neelsen.
As unidades amostrais obtidas das amostras de LG foram inoculadas em meio de cultivo de Löwenstein-Jensen, incubadas a 37 °C por 6 semanas e avaliadas semanalmente quanto à presença de crescimento bacilar. O crescimento e a identificação de Mtb em meio de cultivo de Löwenstein-Jensen foram utilizados como método confirmatório. Três amostras de LG de pelo menos 10 mL foram coletadas de cada paciente em dias diferentes. A quantidade a ser coletada foi definida por meio de um teste laboratorial piloto, uma vez que essa quantidade varia de 5 a 50 mL na literatura.(6,7,14,15)
Amostras positivas de LG foram definidas como aquelas nas quais o Mtb cresceu em uma ou mais culturas de espécimes de lavado. Os resultados da cultura das amostras de LG coletadas em ambiente hospitalar foram comparados aos das amostras de LG coletadas em ambiente ambulatorial.
Embora o método confirmatório seja o teste laboratorial, ele tem baixa sensibilidade e pode levar até 2 meses para produzir resultados. O diagnóstico final de TB nesta casuística baseou-se nos achados clínicos, nos achados laboratoriais, ou em ambos, a critério do médico responsável.
Para se avaliar a associação entre o diagnóstico de TB e o ambiente no qual a amostragem do LG foi realizada, calculou-se o risco relativo para as variáveis categóricas, com um intervalo de confiança de 95%. As variáveis contínuas foram analisadas utilizando-se o teste t para amostras independentes, com um nível de significância de 0,05. Os dados estatísticos foram analisados utilizando-se o programa Stata, versão 7.0 (Stata Corp., College Station, TX, EUA).
O protocolo do estudo foi explicado a todos os pacientes pediátricos com suspeita de TB, antes de sua inclusão no estudo. Os pais de todos os participantes, ou seus responsáveis legais, assinaram o termo de consentimento livre e esclarecido.
O desenho do estudo foi revisado e aprovado pela Junta Institucional de Revisão do Centro Biomédico da Universidade Federal do Espírito Santo (Processo nº 023/99).
ResultadosNão houve diferença significativa entre os grupos hospitalar e ambulatorial em relação às variáveis demográficas (Tabela 1). Além disso, não houve diferença significativa entre os dois grupos em relação à idade, que variou de 8 meses a 14 anos no grupo ambulatorial e de 1 mês a 12 anos no grupo hospitalar.
Das 23 crianças do grupo ambulatorial, 17 (75%) eram da grande Vitória, assim como o eram 22 (73,3%) das 30 crianças do grupo hospitalar.
Entre as variáveis associadas à história clínica, a tosse e a desnutrição apresentaram taxas significativas em ambos os grupos (Tabela 2). Em relação à presença de secreção, não houve diferença entre o grupo ambulatorial (52,1%) e o grupo hospitalar (36,6%). Embora houvesse presença de secreção em algumas das crianças com menos de 5 anos de idade, é difícil coletar escarro de crianças tão jovens.

Os dois grupos não diferiram quanto à freqüência de TB pulmonar: 12,5% das crianças do grupo ambulatorial e 21,1% das do grupo hospitalar apresentaram TB pulmonar e TB extrapulmonar concomitantemente.
Houve contato com um caso-índice adulto em quase todos os casos estudados, e as taxas foram semelhantes em ambos os grupos.
Embora o índice de achados radiológicos compatíveis com TB tenha sido maior no grupo ambulatorial, a diferença entre os dois grupos não foi significativa. No grupo ambulatorial, 72% dos casos apresentaram condensação ou infiltração compatível com o diagnóstico de TB, e 43% apresentaram linfonodomegalia hilar. No grupo hospitalar, 86% dos pacientes cujos achados radiológicos foram compatíveis com TB apresentaram condensação ou infiltração, e 38% apresentaram linfonodomegalia hilar.
Em nosso estudo, a resposta do TT observada foi descrita como acentuada em 11 (47,8%) das 23 crianças do grupo ambulatorial (Tabela 2).
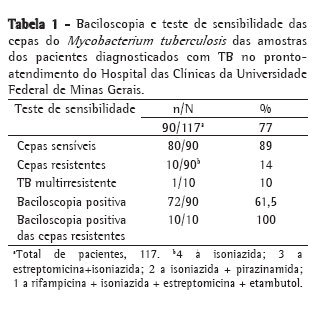
Curiosamente, 2 dos 5 pacientes do grupo ambulatorial com baciloscopia positiva apresentaram culturas negativas. Paralelamente, 3 dos 10 pacientes do grupo hospitalar com baciloscopia positiva apresentaram culturas negativas (Tabela 3). Embora não houvesse diferença significativa entre os dois grupos em relação aos resultados da cultura ou da baciloscopia, a proporção de culturas positivas foi maior no grupo ambulatorial (73,9%) do que no grupo hospitalar (50%).

A taxa de cura foi de 100% em ambos os grupos. No período de acompanhamento, não houve mudança na condição diagnóstica dos dois grupos. Nenhum efeito adverso, além de leve sangramento nasal (em 10%), foi relatado, o que é especialmente surpreendente se considerarmos que cada uma das crianças incluídas foi submetida a 3 procedimentos de LG separados.
Outro resultado importante foi que, nas primeiras amostras, houve 17 culturas positivas no grupo ambulatorial (76,5%) e 15 culturas positivas no grupo hospitalar (73,3%). Nas terceiras amostras, menos de 8% das culturas foram positivas.
DiscussãoDe acordo com dados publicados, os pacientes mais jovens são os que têm maior probabilidade de desenvolver TB. No presente estudo, a grande maioria das crianças diagnosticadas com TB tinha menos de 5 anos de idade.(2,13) Em ambos os grupos, houve predomínio de meninas, o que está de acordo com dados publicados.(17)
Relatos de outros autores sugerem que, entre indivíduos que tiveram contato com um caso-índice, as crianças têm uma probabilidade maior de desenvolver TB do que os adultos.(18-21)
Um estudo demonstrou que 73,1% dos contatos domiciliares com menos de 15 anos de idade foram infectados com Mtb e tiveram uma chance 10,67 vezes maior de desenvolver TB, sendo que 33% realmente desenvolvem a doença.(13)
Outro estudo revelou que 5-10% dos pacientes adultos imunocompetentes e virgens de tratamento infectados com o Mtb irão desenvolver TB durante a vida; entretanto, quando os pacientes pediátricos foram considerados, a chance de desenvolver TB variou significativamente de acordo com a idade da criança: 43% nas crianças com menos de 1 ano de idade, 24% nas crianças com 1 a 5 anos e 15% nas crianças com 10 a 15 anos.(17) Nossos dados reforçam a importância epidemiológica dos contatos domiciliares na cadeia de transmissão da doença.
Outra questão importante é que as crianças infectadas antes dos 4 anos de idade têm uma probabilidade muito maior de desenvolver manifestações clínicas imediatas, manifestações radiológicas, ou ambas, mas têm uma probabilidade muito pequena de apresentar reativação da doença na vida adulta. Por outro lado, as crianças infectadas na pré-adolescência ou na adolescência têm uma probabilidade maior de desenvolver a TB pulmonar do tipo adulto, mais grave, logo após a infecção ou na vida adulta.(19)
Os sintomas clínicos relatados em nosso estudo corroboram os dados de um outro estudo realizado no Brasil, e, de todos os sintomas clínicos, a tosse persistente foi o sintoma mais freqüentemente relatado em ambos os estudos (75% de todos os pacientes incluídos).(20) A análise dos achados radiológicos ajudou a confirmar o diagnóstico de TB em ambos os grupos em nosso estudo, assim como em um outro estudo que mostrou que os dados radiológicos aumentaram em 25,4 vezes a chance de um diagnóstico positivo de TB em crianças.(13)
O índice de TTs positivos obtido em nosso estudo (47,8% no grupo hospitalar e 38,1% no grupo ambulatorial) difere dos dados publicados anteriormente. De fato, os resultados dos TTs variam consideravelmente e dependem de vários fatores, tais como idade, estado nutricional, estado de vacinação BCG e infecção pelo HIV.(12) Um grupo de autores avaliou 49 crianças com TB pulmonar e verificou que 45 (91,9%) apresentaram uma reação acentuada no TT.(20) Em um outro estudo, foi relatado que somente 7 (15,5%) das 45 crianças incluídas apresentaram uma reação acentuada no TT.(16) Embora apresentem uma variabilidade significativa em pacientes pediátricos com TB, em comparação a indivíduos sem TB, os resultados de TT são um importante marcador indireto da TB. Uma das limitações do nosso estudo foi o TT. Quando o estudo começou, a realização de TT em crianças com menos de 2 anos de idade não era uma prática preconizada pelo Ministério da Saúde em razão da reação cruzada com a vacinação BCG. Em 2002, isso foi mudado com base na modificação do ponto de corte para 15 mm.(12) Portanto, somente 44 das 53 crianças foram submetidas a TTs, conforme mostra a Tabela 2.
Os achados micobacteriológicos são muito importantes para o diagnóstico de TB. Entretanto, é extremamente difícil obter-se uma baciloscopia positiva ou uma cultura positiva em pacientes pediátricos. Em nosso estudo, as culturas das amostras de LG produziram melhores resultados diagnósticos.
Um estudo realizado na Cidade do Cabo, África do Sul, obteve resultados promissores em crianças com 1 mês a 5 anos de idade, nas quais a indução de escarro mostrou ser segura e útil para a confirmação microbiológica da TB. Embora essa técnica seja preferível ao LG para o diagnóstico da TB pulmonar, até o momento, ela não foi usada em crianças mais jovens.(20) Uma limitação desses achados é a dificuldade de se implantar a indução de escarro em larga escala, uma vez que são necessárias salas especiais com pressão negativa de ar.
Embora se recomende que o LG seja realizado em ambiente hospitalar,(12,21) os dados aqui apresentados sugerem que não há diferença significativa entre as amostras coletadas em ambiente hospitalar e as coletadas em ambiente ambulatorial em relação à cultura positiva para o Mtb, o que está de acordo com os achados de Lobato et al.(11) Também foi relatado que o LG pode provocar estimulação vagal.(23) Entretanto, isso não foi observado no presente estudo. Uma outra limitação é o pequeno tamanho da casuística, embora essa limitação possa ter sido atenuada pelo fato de que a medida de associação estava desviada em direção ao grupo hospitalar.
As taxas de cura e de diagnóstico correto foram as mesmas em ambos os grupos, o que parece mostrar que o ambiente no qual o LG é realizado é menos importante do que os padrões para a definição de casos de TB na infância. Em geral, há um certo ceticismo em relação ao valor potencial de abordagens diagnósticas baseadas em sintomas, uma vez que as atuais abordagens diagnósticas clínicas são freqüentemente validadas de forma precária. Entretanto, foi demonstrado que a TB pulmonar pode ser diagnosticada com um grau razoável de acurácia em crianças não infectadas pelo HIV utilizando-se uma abordagem simples baseada em sintomas.(5,16)
O sistema de pontuação proposto pelo Ministério da Saúde do Brasil para o diagnóstico da TB na infância é, em nossa opinião, o melhor sistema para padronizar o diagnóstico de casos de TB em nosso meio.(24,25) Um dos obstáculos à discussão sobre a TB na infância é a falta de uma terminologia descritiva padrão para classificar o amplo espectro da doença. A classificação precisa da doença é importante, uma vez que a correta identificação da entidade específica da doença tem um valor prognóstico definido. A classificação precisa também irá melhorar as definições de desfecho dos estudos e facilitar a comunicação científica.
Nosso estudo reforça a hipótese da realização da amostragem do LG sem a necessidade de internação do paciente-um fato de grande relevância, especialmente em países em desenvolvimento, onde o número de leitos hospitalares disponíveis é extremamente limitado. O procedimento pode ser realizado em ambiente ambulatorial sem prejudicar a acurácia dos resultados da cultura. Embora o rendimento dos aspirados gástricos seja relativamente baixo, informações importantes, incluindo padrões de sensibilidade a medicamentos, podem ser obtidas.(11)
Embora a restrição da internação a casos mais complexos, a redução dos custos e a redução do stress do paciente sejam questões importantes, ainda é preciso usar um sistema de pontuação antes da realização do LG. Uma vez estabelecida essa rotina, reduzir-se-á o número de pacientes que são submetidos ao procedimento desnecessariamente, e aumentar-se-á o número de pacientes nos quais as amostras precisam ser coletadas. Com base em nossos resultados, parece possível considerarem-se somente as duas primeiras amostras e não todas as três amostras como é recomendado em diretrizes para TB. Isso reduzirá o stress do paciente e o desconforto relacionado à repetição do procedimento.
Apesar de causar considerável mortalidade e morbidade, a TB na infância é um aspecto negligenciado nos programas nacionais de controle da TB.(26) Isso ocorre no Brasil, onde as diretrizes oficiais dão pouca atenção a essa questão. Por meio de nossa pesquisa, esperamos encorajar o repensar de estratégias básicas de controle da TB para que se abordem problemas específicos da TB na infância.
Referências 1. Frieden TR, Sterling TR, Munsiff SS, Watt CJ, Dye C. Tuberculosis. Lancet. 2003;362(9387):887-99.
2. Starke JR. Childhood tuberculosis. A diagnostic dilemma. Chest. 1993;104(2):329-30.
3. Sant'Anna CC, Mourgues LV, Ferrero F, Balanzat AM. Diagnóstico e Terapêutica da Tuberculose Infantil - uma visão atualizada de um antigo problema. J Pediatr (Rio J). 2002;78(Supl 2): 205-14.
4. Maciel ELN, Marinato CA , Bandeira CFR, Tonini MS, Dietze R, Ramos MC. O perfil epidemiológico da tuberculose em crianças e adolescentes menores de 15 anos na Grande Vitória, Brasil, no período de 1990-2001. Cad Saúde Colet. 2006;14(1):81-94.
5. Marais BJ, Gie RP, Hesseling AC, Schaaf HS, Lombard C, Enarson DA, et al. A refined symptom-based approach to diagnose pulmonary tuberculosis in children. Pediatrics. 2006;118(5):e1350-9.
6. Feigin, RD, Cherry, JD. Textbook of Pediatric Infectious Diseases. 3rd ed. Philadelphia: W. B. Saunders Company; 1992. p.1321-1362.
7. Houwert KA, Borggreven PA, Schaaf HS, Nel E, Donald PR, Stolk J. Prospective evaluation of World Health Organization criteria to assist diagnosis of tuberculosis in children. Eur Respir J. 1998;11(5):1116-20.
8. Pomputius WF 3rd, Rost J, Dennehy PH, Carter EJ. Standardization of gastric aspirate technique improves yield in the diagnosis of tuberculosis in children. Pediatr Infect Dis J. 1997;16(2):222-6.
9. Gómez Pastrana Durán D, Torronteras Santiago R, Caro Mateo P, López Barrio AM, Macías Mardones P, Andrés Martín A, et al. [Effectiveness of smears and cultures in gastric aspirate samples in the diagnosis of tuberculosis][Article in Spanish]. An Esp Pediatr. 2000;53(5):405-11.
10. Laven GT. Diagnosis of tuberculosis in children using fluorescence microscopic examination of gastric washings. Am Rev Respir Dis. 1977;115(5):743-9.
11. Lobato MN, Loeffler AM, Furst K, Cole B, Hopewell PC. Detection of Mycobacterium tuberculosis in gastric aspirates collected from children: hospitalization is not necessary. Pediatrics. 1998;102(4):E40.
12. Brasil. Ministério da Saúde. Fundação Nacional de Saúde- Centro de Referência Prof. Hélio Fraga. Sociedade Brasileira de Pneumologia e Tisiologia. Controle de Tuberculose: Uma Proposta de Integração Ensino - Serviço. 5th ed. Rio de Janeiro: FUNASA/CRPHF/SBPT; 2002.
13. Sant´Anna CC. Tuberculose na Infância e na Adolescência. São Paulo: Atheneu; 2002.
14. Migliori GB, Borghesi A, Rossanigo P, Adriko C, Neri M, Santini S, et al. Proposal of an improved score method for the diagnosis of pulmonary tuberculosis in childhood in developing countries. Tuber Lung Dis. 1992;73(3):145-9.
15. Somu N, Swaminathan S, Paramasivan CN, Vijayasekaran D, Chandrabhooshanam A, Vijayan VK, et al. Value of bronchoalveolar lavage and gastric lavage in the diagnosis of pulmonary tuberculosis in children. Tuber Lung Dis. 1995;76(4):295-9.
16. Sant'Anna CC, Orfaliais CT, March Mde F. A retrospective evaluation of a score system adopted by the Ministry of Health, Brazil in the diagnosis of pulmonary tuberculosis in childhood: a case control study. Rev Inst Med Trop Sao Paulo. 2003;45(2):103-5.
17. Behrman RE, Jeson HB, Kliegman RM. Nelson: Tratado de Pediatria. 16 ed. Rio de Janeiro: Guanabara Koogan; 1997.
18. Miller FJ, Seale RM, Taylor MD. Tuberculosis in children. Boston: Little Brown; 1963.
19. Starke JR. Tuberculosis in children. Semin Respir Crit Care Med. 2004;25(3):353-64.
20. Picon PD, Rizzon CF, Ott WP. Tuberculose: epidemiologia, diagnóstico e tratamento em clínica e saúde pública. Rio de Janeiro: Médica e Científica; 1993.
21. Zar HJ, Hanslo D, Apolles P, Swingler G, Hussey G. Induced sputum versus gastric lavage for microbiological confirmation of pulmonary tuberculosis in infants and young children: a prospective study. Lancet. 2005;365(9454):130-4. Erratum in: Lancet. 2005;365(9475):1926.
22. Kritski AL, Conde MB, Souza GR. Tuberculose: do ambulatório á enfermaria. São Paulo: Atheneu; 1999.
23. Castan Vidal ML, Vidal Lopez ML, Cerro Marin MJ, Rey Duran R, Ortega Calderon A, Garcia-Hortelano J. (1991). Contactos infantiles de enfermos tuberculosos. An Esp Pediat. 34(2):129-31.
24. Maciel EL, Dietze R, Struchiner CJ. Avaliação de sistemas de pontuação para o diagnóstico da tuberculose na infância. Cad Saúde Colet. 2006;14(4):655-4.
25. Maciel EL. Avaliação do diagnóstico da tuberculose na infância. [thesis]. Rio de Janeiro: Universidade do Estado do Rio de Janeiro; 2004.
26. Donald PR, Maher D, Qazi S. A research agenda to promote the management of childhood tuberculosis within national tuberculosis programmes. Int J Tuberc Lung Dis. 2007;11(4):370-80.
____________________________________________________________________________________________________________________
Trabalho realizado na Unidade 2 do Centro de Doenças Infecciosas. Fundação Oswaldo Cruz - Fiocruz - Rio de Janeiro (RJ) Brasil.
1. Professor Adjunto de Epidemiologia. Universidade Federal do Espírito Santo - UFES - Vitória (ES) Brasil.
2. Professor Adjunto de Medicina. Universidade Federal do Espírito Santo - UFES - Vitória (ES) Brasil.
3. Biólogo do Centro de Doenças Infecciosas. Universidade Federal do Espírito Santo - UFES - Vitória (ES) Brasil.
4. Professor Adjunto de Microbiologia. Universidade Federal do Espírito Santo - UFES - Vitória (ES) Brasil.
5. Professor Adjunto de Imunologia. Universidade Federal do Espírito Santo - UFES - Vitória (ES) Brasil.
6. Pesquisador Titular. Fundação Oswaldo Cruz - Fiocruz - Rio de Janeiro (RJ) Brasil.
Endereço para correspondência: Ethel Leonor Noia Maciel. Núcleo de Doenças Infecciosas, Centro de Ciências da Saúde/UFES, Av. Marechal Campos, 1468, CEP 29040-090, Maruípe,Vitória, ES, Brasil.
Tel 55 27 3335-7210. E-mail: emaciel@ndi.ufes.br
Apoio financeiro: Rede Brasileira de Pesquisa em Tuberculose (Rede-TB).
Recebido para publicação em 6/6/2007. Aprovado, após revisão, em 10/9/2007.







