Cristina Salles, Regina Terse Trindade Ramos, Carla Daltro, Andréa Barral, Jamocyr Moura Marinho, Marcos Almeida Matos
ABSTRACT
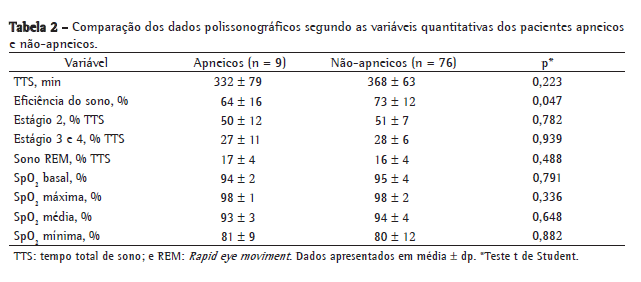
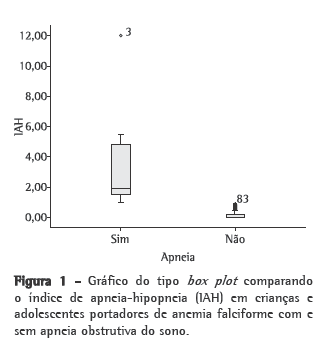
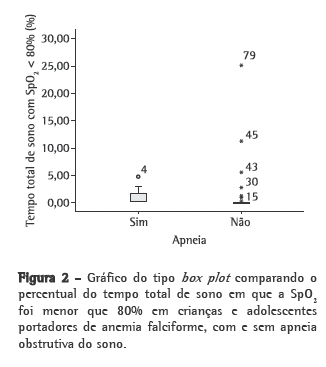
Objective: To estimate the prevalence of obstructive sleep apnea syndrome (OSAS) in children and adolescents with sickle cell anemia (SCA); to investigate the possible correlation between mean annual hemoglobin level and total sleep time with SpO2 < 90%, as well as between mean annual hemoglobin level and total sleep time with SpO2 < 80%; and to investigate the possible correlation between apnea-hypopnea index (AHI) and painful crisis. Methods: The study involved 85 patients with SCA. The patients completed a questionnaire, were submitted to polysomnography and underwent clinical evaluation (by a pediatrician and an otolaryngologist). An AHI > 1 was considered indicative of a diagnosis of OSAS. Results: The prevalence of OSAS was 10.6%. We found a negative correlation between mean annual hemoglobin level and total sleep time with SpO2 < 90% (r = −0.343; p = 0.002), as well as between mean annual hemoglobin level and total sleep time with SpO2 < 80% (r = −0.270; p = 0.016). There was no association between AHI and painful crisis. Conclusions: The prevalence of OSAS in this population was high (10.6%). Therefore, it is important to identify signs of OSAS as soon as possible and to determine the mean annual hemoglobin level because of the inverse correlation between that level and the total sleep time with SpO2 < 90% or < 80%.
Keywords: Prevalence; Sleep apnea, obstructive; Anemia, sickle cell; Polysomnography; Sleep apnea syndromes.
RESUMO
Objetivo: Estimar a prevalência da síndrome da apneia obstrutiva do sono (SAOS) em crianças e adolescentes com anemia falciforme (AF) e investigar a possível correlação entre hemoglobina anual média e tempo total de sono com SpO2 < 90% e tempo total de sono com SpO2 < 80%, assim como investigar a possível correlação entre o índice de apneia-hipopneia (IAH) e episódios de crise álgica. Métodos: Participaram 85 pacientes com AF, que responderam a um questionário, foram avaliados por um pediatra e um otorrinolaringologista, e submetidos a estudo polissonográfico. O diagnóstico de SAOS foi definido como IAH > 1. Resultados: A prevalência da SAOS foi 10,6%. Observou-se uma correlação negativa entre hemoglobina anual média e tempo total de sono com SpO2 < 90% (r = −0,343; p = 0,002) e tempo total de sono com SpO2 < 80% (r = −0,270; p = 0,016). Não foi observada associação entre IAH e episódios de crise álgica. Conclusões: A prevalência da SAOS nesta população foi alta (10,6%). Portanto, é importante identificar precocemente os sinais de SAOS e avaliar hemoglobina anual média, devido à correlação inversa entre essa e o tempo total de sono com SpO2 < 90% ou < 80%.
Palavras-chave: Prevalência; Apneia do sono tipo obstrutiva; Anemia falciforme; Polissonografia; Síndromes da apneia do sono.
Introdução