ABSTRACT
Objective: To estimate the prevalence of undiagnosed COPD among individuals with risk factors for the disease treated at primary health care clinics (PHCCs) in the city of Aparecida de Goiânia, Brazil. Methods: Inclusion criteria were being ≥ 40 years of age, having a > 20 pack-year history of smoking or a > 80 hour-year history of exposure to biomass smoke, and seeking medical attention at one of the selected PHCCs. All subjects included in the study underwent spirometry for the diagnosis of COPD. Results: We successfully evaluated 200 individuals, mostly males. The mean age was 65.9 ± 10.5 years. The diagnosis of COPD was confirmed in 63 individuals, only 18 of whom had been previously diagnosed with COPD (underdiagnosis rate, 71.4%). There were no significant differences between the subgroups with and without a previous diagnosis of COPD in relation to demographics and risk factors. However, there were significant differences between these subgroups for the presence of expectoration, wheezing, and dyspnea (p = 0.047; p = 0.005; and p = 0.047, respectively). The FEV1 and FEV1/FVC ratio, expressed as percentages of the predicted values, were significantly lower in the subjects with a previous diagnosis of COPD, which was predominantly mild or moderate in both subgroups. Conclusions: The rate of underdiagnosis of COPD was high at the PHCCs studied. One third of the patients with risk factors for COPD met the clinical and functional criteria for the disease. It seems that spirometry is underutilized at such facilities.
Keywords:
Pulmonary disease, chronic obstructive/diagnosis; Primary health care; Spirometry.
RESUMO
Objetivo: Estimar a prevalência de DPOC não diagnosticada entre indivíduos com fatores de risco para a doença atendidos em unidades de estratégia de saúde da família (UESF) na cidade de Aparecida de Goiânia (GO). Métodos: Os critérios de inclusão foram ter idade ≥ 40 anos, ter história de tabagismo > 20 maços-ano ou de exposição à queima de biomassa > 80 horas-ano e procurar atendimento médico em uma das UESF selecionadas. Todos os indivíduos incluídos no estudo foram submetidos a espirometria para a definição diagnóstica de DPOC. Resultados: Foram avaliados com sucesso 200 indivíduos, a maioria do sexo masculino. A média de idade foi de 65,9 ± 10,5 anos. Tiveram confirmação diagnóstica de DPOC 63 indivíduos. Desses, apenas 18 haviam sido previamente diagnosticados com DPOC (taxa de subdiagnóstico de 71,4%). Não houve diferenças significantes entre os subgrupos com e sem diagnóstico prévio de DPOC em relação a fatores demográficos e fatores de risco. Entretanto, houve diferenças significantes entre esses subgrupos em relação à presença de expectoração, chiado e dispneia (p = 0,047, p = 0,005 e p = 0,047, respectivamente). Os valores de VEF1 e VEF1/CVF, em percentual do previsto, foram significativamente menores nos indivíduos com diagnóstico prévio de DPOC. A DPOC foi predominantemente leve a moderada em ambos os subgrupos. Conclusões: A taxa de subdiagnóstico da DPOC foi alta nas UBS estudadas. Um terço dos pacientes com fatores de risco para DPOC apresentou critérios clínicos e funcionais para a doença. A espirometria foi subutilizada.
Palavras-chave:
Doença pulmonar obstrutiva crônica/diagnóstico; Atenção primária à saúde; Espirometria.
IntroduçãoAs doenças respiratórias crônicas representam um dos maiores problemas de saúde pública no mundo, afetando a qualidade de vida das pessoas e gerando incapacidade física e grande impacto socioeconômico.(1)
Os óbitos por DPOC estão projetados para aumentar em 30% nos próximos 10 anos, a menos que medidas sejam tomadas para reduzir os fatores de risco e o subdiagnóstico. As estimativas mostram que a DPOC será a terceira maior causa de morte no mundo em 2030.(1)
O subdiagnóstico da DPOC e, consequentemente, a falta de tratamento são pontos cardinais do combate mundial da doença. Outra faceta importante é que a DPOC não é vista como uma doença sistêmica e, portanto, não é avaliada como parte do sistema de vigilância das doenças crônicas, que incluem doenças cardiovasculares e doenças metabólicas.(1)
A realização de estudos e intervenções relacionados ao diagnóstico da DPOC na atenção primária se faz necessária para a detecção precoce e o melhor controle da doença. O estudo aqui descrito teve como objetivo averiguar o diagnóstico de DPOC entre usuários de unidades básicas de saúde que apresentassem fatores de risco para a doença, mas que não são investigados na rotina de atendimento das unidades.
MétodosEstudo analítico, observacional, transversal, realizado na cidade de Aparecida de Goiânia (GO), em três Unidades de Estratégia de Saúde da Família (UESF) no período entre maio e setembro de 2011. Contou com o apoio dos gestores da Secretaria Municipal de Saúde de Aparecida de Goiânia, cidade da região metropolitana de Goiânia com população estimada em 500 mil pessoas. O critério de escolha das UESF foi ter a maior representatividade populacional (regiões sul, leste e oeste). Essas unidades correspondem a 27% do atendimento geral das UESF (segundo informações da secretaria municipal). Os indivíduos que procuravam as UESF para atendimento médico ambulatorial de rotina e que não apresentavam sintomas respiratórios agudos foram convidados a responder uma entrevista inicial sobre dados demográficos e fatores de risco para DPOC. Foram incluídos indivíduos com idade maior ou igual a 40 anos, exposição a tabaco igual ou maior que 20 anos-maço ou exposição a queima de biomassa igual ou maior a 80 horas-ano ou ambos e que concordaram em assinar o termo de consentimento livre e esclarecido. Foram excluídos os indivíduos com diagnóstico prévio de asma brônquica, rinite alérgica, doenças pulmonares crônicas que não DPOC e enfermidades extrapulmonares capazes de interferir na função pulmonar, assim como aqueles que não preencheram os requisitos para a realização da espirometria (Figura 1).

Nos indivíduos que preencheram os critérios de inclusão foi aplicado o questionário principal de um estudo de prevalência(2) em versão adaptada. Foram obtidos dados demográficos e clínicos (sintomas respiratórios, como tosse, expectoração, chiado e dispneia, e diagnóstico médico prévio de enfisema, bronquite crônica ou DPOC, com realização ou não de espirometria), assim como variáveis relacionadas a exposições ao tabaco e à queima de lenha.
A quantificação de exposição à queima de lenha foi baseada nos níveis de exposição considerados em estudos prévios.(2)
Para a avaliação da função pulmonar, utilizou-se um espirômetro Spirotrac® (Vitalograph, Buckingham, Reino Unido), calibrado diariamente. A espirometria foi realizada antes e após a utilização de broncodilatador, com base nos critérios da Sociedade Brasileira de Pneumologia e Tisiologia(3) e os resultados foram interpretados de acordo com os valores previstos por Pereira et al.(4) As variáveis espirométricas estudadas foram CVF, VEF1 e relação VEF1/CVF.
Os critérios usados para a definição do diagnóstico de DPOC nos indivíduos incluídos no estudo foi ter resultado de relação VEF1/CVF, em valor absoluto, após o uso de broncodilatador < 0,70. Para a classificação de gravidade da DPOC, foram utilizados os critérios da Global Initiative for Chronic Obstructive Lung Disease (GOLD).(1)
Foi considerado como paciente com diagnóstico presuntivo prévio aquele que havia recebido diagnóstico médico prévio de enfisema, bronquite crônica ou DPOC.
O tamanho da amostra foi calculado estimando-se a proporção populacional com precisão absoluta específica e utilizando-se uma fórmula.(5) Assumiu-se a prevalência máxima de DPOC na população do município em 25%, considerando-se o resultado de um estudo de prevalência na população brasileira.(2) Com um nível de confiança de 95% e com precisão absoluta de 6%, foi calculada uma amostra mínima necessária de 200 indivíduos.
Para análise estatística, recorreu-se ao programa Statistical Package for the Social Sciences, versão 15 (SPSS Inc., Chicago, IL, EUA), com a realização de análise de regressão logística e cálculo de OR. O nível de significância estatística adotado foi de p < 0,05.
O presente estudo foi aprovado pelo Comitê de Ética em Pesquisa Humana do Hospital das Clínicas da Universidade Federal de Goiás, registro nº 202/2010.
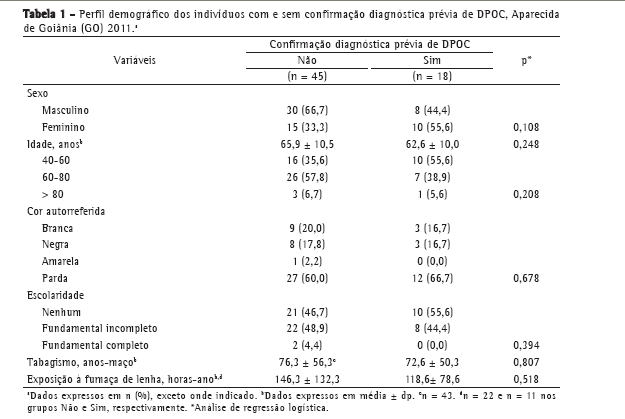
ResultadosForam selecionados 200 indivíduos, dos quais 63 apresentaram diagnóstico de DPOC. A média de idade dos participantes foi de 65,0 ±10,40 anos, com predomínio na faixa etária de 60-80 anos. A maioria dos indivíduos apresentou grau de escolaridade baixo. A cor autorreferida como parda foi predominante.
Em relação aos fatores de risco (carga tabágica, exposição à queima de lenha e tipo de cigarro fumado), não houve diferenças estatisticamente significantes entre os indivíduos com DPOC e sem DPOC.
Do total de 63 indivíduos com diagnóstico de DPOC, 45 não relataram diagnóstico prévio, o que determinou um percentual de subdiagnóstico de 71,4%. Entre os 137 indivíduos que não preencheram o diagnóstico de DPOC, 20 relataram diagnóstico prévio; portanto, detectou-se diagnóstico incorreto ou de sobrediagnóstico em 14,6% desses indivíduos.
Somente 5,6% dos indivíduos com diagnóstico prévio de DPOC tinham realizado espirometria. Considerando os 200 indivíduos estudados com indicação de espirometria pelo fator de risco tabaco e fumaça de lenha, o grau de utilização da espirometria como ferramenta diagnóstica foi de 1,5%.
A análise das variáveis sexo, idade, cor e escolaridade não demonstrou diferença estatisticamente significante entre os grupos com e sem diagnóstico prévio de DPOC. Não houve, também, diferenças estatisticamente significantes em relação à carga tabágica e à exposição cumulativa à queima de lenha. No grupo de indivíduos com DPOC sem diagnóstico prévio, a média de idade foi de 65,9 ± 10,5 anos e houve predomínio do sexo masculino, da cor autorreferida parda e de grau de escolaridade ensino fundamental incompleto. Além disso, nesse grupo, a carga tabágica média foi de 76,3 ± 56,3 anos-maço e a exposição cumulativa média à fumaça de lenha foi 146,0 ± 132,3 horas-ano (Tabela 1).
O grupo com DPOC e diagnóstico prévio apresentou maior frequência de tosse, expectoração, chiado e dispneia quando comparado ao grupo sem diagnóstico prévio, com diferenças estatisticamente significantes para os três últimos sintomas. O nível de dispneia no grupo com diagnóstico prévio foi classificado como 2 pela escala do Medical Research Council em 44,4% (Tabela 2).

Os valores de VEF1 e da relação VEF1/CVF, em percentual do previsto, foram significativamente menores naqueles indivíduos que tinham diagnóstico prévio de DPOC. A DPOC foi predominantemente leve a moderada no grupo sem diagnóstico prévio (Tabela 3).
 Discussão
DiscussãoO presente estudo mostrou um percentual de 71,4% de subdiagnóstico da DPOC em indivíduos com fatores de risco atendidos na atenção primária. Os indivíduos com diagnóstico presuntivo prévio apresentaram maior expressão clínica da doença no momento da avaliação do estudo e maior índice de obstrução brônquica.
Outro estudo(6) realizado para documentar a extensão do subdiagnóstico da DPOC em pacientes de risco na atenção primária sugeriu que, se, houver triagem em fumantes acima de 40 anos, pode-se detectar de 10-20% de casos não diagnosticados de DPOC. Os autores chamaram atenção também para os prováveis motivos do subdiagnóstico, afirmando que os médicos não estariam plenamente conscientes da importância dos fatores de risco e dos sintomas para a DPOC, assim como não dominariam conhecimentos sobre critérios espirométricos para a definição da doença. Os pacientes, por sua vez, só procurariam orientação médica quando os sintomas afetassem sua qualidade de vida.
No presente estudo, em referência à caracterização dos fatores de risco (tabaco e exposição cumulativa à fumaça de lenha) e aos dados demográficos, não houve diferenças entre os subgrupos com e sem diagnóstico prévio de DPOC.
Os pacientes com DPOC do presente estudo apresentaram média de idade mais elevada que o grupo sem DPOC. A idade é frequentemente listada como um fator de risco para a DPOC.(1,2) Vários estudos mostram que o percentual da doença tende a aumentar com o aumento da idade.(7-9)
Dados de trabalhos publicados em várias partes do mundo confirmam que a DPOC está subdiagnosticada especialmente nas mulheres e que, na comunidade médica e principalmente na atenção primária, haveria uma tendência para diagnosticar a DPOC mais frequentemente em homens.(10,11)
Nos países em desenvolvimento, como o Brasil, além do tabagismo, existe outro fator de impacto para a DPOC, que é a exposição à queima de biomassa, principalmente em áreas rurais, onde as mulheres cozinham em ambientes pouco ventilados. Um estudo brasileiro(12) detectou DPOC em 47 de 160 mulheres recrutadas em unidades básicas de saúde que apresentavam exposição cumulativa à fumaça de lenha de 211,2 ± 98,2 horas-ano.
Jain et al.(13) avaliaram 702 pacientes portadores de DPOC em relação a fatores etiológicos e de risco para a doença, assim como diferenças por sexo na apresentação clinica, radiológica e presença de comorbidades. Os autores observaram que, em comparação aos homens, as mulheres eram mais jovens, relatavam mais sintomas e exacerbações e apresentavam maior prevalência de características sistêmicas. A fumaça do tabaco foi o tipo de exposição predominante no sexo masculino, enquanto a fumaça da queima de biomassa foi a exposição predominante em mulheres. Os autores ressaltaram que entender essas diferenças ajuda no diagnostico precoce da DPOC em mulheres.
No presente estudo, a escolaridade foi menor no grupo com DPOC, o que coincide com resultados de outros estudos(1,2,14) sobre a DPOC associada ao tabaco e à exposição cumulativa de queima de biomassa, estudos esses que também apontaram o baixo nível socioeconômico e menor escolaridade como fatores de risco para DPOC e que a prevalência de DPOC tende a diminuir com o aumento da escolaridade.
Hamers et al.(15) realizaram um estudo nas regiões norte e nordeste do Brasil para medir a prevalência de doenças respiratórias crônicas no atendimento primário. Os autores ressaltaram que os clínicos gerais, em sua maioria, haviam sido treinados em contextos especializados e que desconheciam a taxa de prevalência da DPOC na população. O trabalho mostrou também, em análise bivariada, que idade elevada, sexo masculino, tabagismo e presença de dois sintomas respiratórios associados são fortes preditores de DPOC na avaliação inicial de indivíduos atendidos em unidades de atendimento primário.
No presente estudo, os indivíduos com DPOC com diagnóstico prévio apresentaram maior prevalência de sintomas em relação aos que não tiveram diagnóstico prévio, levando a crer que pacientes com mais sintomas seriam mais facilmente diagnosticados. Isso é preocupante porque faz supor que o diagnóstico foi feito em fases avançadas nas quais há maior expressão clínica da doença, fato também sugerido em outro estudo.(16)
No estudo ora relatado, a presença de dispneia como fator isolado foi predominante nos indivíduos com diagnóstico prévio de DPOC, incluindo também indivíduos diagnosticados erroneamente com DPOC, o que leva a crer que o sintoma dispneia esteja sendo correlacionado erroneamente com o diagnóstico de enfisema pulmonar e, consequentemente, de DPOC. Os indivíduos com diagnóstico prévio de DPOC tinham maior grau de obstrução, considerando-se os valores de VEF1 em percentual do previsto, o que pode se relacionar com a presença de maior frequência de sintomas respiratórios em um grau mais avançado da doença. Orientações fornecidas pelo GOLD(1) reforçam o papel dos programas de detecção precoce da DPOC e recomendam que, quando a espirometria não estiver disponível, o diagnóstico deve ser feito por meio de todos os dados possíveis.
Hill et al.(17) verificaram que, aproximadamente, um em cada cinco adultos com fatores de risco para DPOC que visitaram um médico de atenção primária, por qualquer motivo, apresentaram critérios espirométricos para DPOC. Embora mais de três quartos dos pacientes com DPOC relataram pelo menos um sintoma respiratório, dois terços não sabiam de seu diagnóstico. Os autores concluíram que selecionar indivíduos para realizar espirometria com base apenas em sintomas identificará menos da metade daqueles pacientes com DPOC de moderada a grave e que a espirometria deve ser utilizada como informação complementar aos questionários de procura de casos. Outros estudos sugerem(18-20) que adultos com fatores de risco para DPOC e sintomas respiratórios usuais que procurem atendimento em unidades primárias devem ser alvos prioritários para a triagem e a intervenção precoce.
No presente estudo, os indivíduos com diagnóstico de DPOC com diagnóstico prévio tiveram um maior grau de obstrução, considerando-se VEF1 em percentual do previsto, o que pode se correlacionar com a presença de maior frequência de sintomas nesse subgrupo. O grau de obstrução predominante foi o estádio leve e moderado em ambos os grupos. Outros estudos relataram estádios semelhantes.(18,21)
Além do percentual de 71,4% de subdiagnóstico, foram observados 14,6% de sobrediagnóstico e um índice de utilização da espirometria como ferramenta diagnóstica de 1,5%. Esses resultados são concordantes com os de outros estudos,(2,14,22) nos quais se verificou a baixa utilização da espirometria para o diagnóstico da DPOC na atenção primária.
A utilização de um modelo metodológico de estudo de prevalência poderia permitir a extrapolação para uma população maior, o que não seria possível no presente estudo em virtude do método utilizado. Todavia, o estudo foi feito em unidades básicas de saúde, cujos médicos são clínicos gerais, ou seja, em unidades representativas do perfil da atenção primária no estado de Goiás.
Perante o elevado grau de subdiagnóstico de DPOC encontrado no presente estudo em indivíduos com fatores de risco para a doença atendidos na atenção primaria, sugere-se que a busca ativa no diagnóstico de DPOC e a realização da espirometria podem ser medidas de grande impacto para o controle dessa doença.
Referências
1. Global Initiative for Chronic Obstructive Lung Disease - GOLD [homepage on the Internet]. Bethesda: Global Initiative for Chronic Obstructive Lung Disease [cited 2011 Dec 26]. Global Strategy for the Diagnosis, Management, and Prevention of COPD - Revised 2011. [Adobe Acrobat document, 90p.]. Available from: http://www.goldcopd.org/uploads/users/files/GOLD_Report_2011_Feb21.pdf
2. Menezes AM, Perez-Padilla R, Jardim JR, Muiño A, Lopez MV, Valdivia
G, et al. Chronic obstructive pulmonary disease in five Latin American cities (the PLATINO study): a prevalence study. Lancet. 2005;366(9500):1875-81. http://dx.doi.org/10.1016/S0140-6736(05)67632-5
3. Sociedade Brasileira de Pneumologia e Tisiologia. Diretrizes para testes de função pulmonar. J Pneumol. 2002;28(Suppl 3):S2-S238.
4. Pereira CA, Sato T, Rodrigues SC. New reference values for forced spirometry in white adults in Brazil. J Bras Pneumol. 2007;33(4):397-406. PMid:17982531. http://dx.doi.org/10.1590/S1806-37132007000400008
5. Lwanga SK, Lemeshow S. Sample Size Determination in Health Studies. Geneva: World Health Organization; 1991.
6. Tinkelman DG, Price D, Nordyke RJ, Halbert RJ. COPD screening efforts in primary care: what is the yield? Prim Care Respir J. 2007;16(1):41-8. PMid:17297526. http://dx.doi.org/10.3132/pcrj.2007.00009
7. Yamasaki A, Hashimoto K, Hasegawa Y, Okazaki R, Yamamura M, Harada T, et al. COPD is frequent in conditions of comorbidity in patients treated with various diseases in a university hospital. Int J Chron Obstruct Pulmon Dis. 2010;5:351-5. PMid:21037959 PMCid:2962301. http://dx.doi.org/10.2147/COPD.S12669
8. Lundbäck B, Gulsvik A, Albers M, Bakke P, Rönmark E, van den Boom G, et al. Epidemiological aspects and early detection of chronic obstructive airway diseases in the elderly. Eur Respir J Suppl. 2003;40:3s-9s. PMid:12762567. http://dx.doi.org/10.1183/09031936.03.00403103
9. Lindberg A, Jonsson AC, Rönmark E, Lundgren R, Larsson LG, Lundbäck B. Prevalence of chronic obstructive pulmonary disease according to BTS, ERS, GOLD and ATS criteria in relation to doctor's diagnosis, symptoms, age, gender, and smoking habits. Respiration. 2005;72(5):471-9. PMid:16210885. http://dx.doi.org/10.1159/000087670
10. de Torres Tajes JP, Macario CC. Chronic obstructive pulmonary disease in women [Article in Spanish]. Arch Bronconeumol. 2010;46 Suppl 3:23-7. http://dx.doi.org/10.1016/S0300-2896(10)70023-5
11. Soares S, Costa I, Neves AL, Couto L. Caracterização de uma população com risco acrescido de DPOC. Rev Port Pneumol. 2010;16(2):237-52. Pmid:20437002.
12. Moreira MA. Avaliação de aspectos pulmonares em mulheres expostas à fumaça de combustão de lenha [thesis]. Goiânia: Universidade federal de Goiás; 2011.
13. Jain NK, Thakkar MS, Jain N, Rohan KA, Sharma M. Chronic obstructive pulmonary disease: Does gender really matter? Lung India. 2011;28(4):258 62. PMid:22084538 PMCid:3213711. http://dx.doi.org/10.4103/0970-2113.85686
14. Peña VS, Miravitlles M, Gabriel R, Jiménez-Ruiz CA, Villasante C, Masa JF, et al. Geographic variations in prevalence and underdiagnosis of COPD: results of the IBERPOC multicentre epidemiological study. Chest. 2000;118(4):981-9. PMid:11035667. http://dx.doi.org/10.1378/chest.118.4.981
15. Hamers R, Bontemps S, van den Akker M, Souza R, Penaforte J,
Chavannes N. Chronic obstructive pulmonary disease in Brazilian primary
care: Diagnostic competence and case-finding. Prim Care Respir J. 2006;15(5):299 306. PMid:16978923. http://dx.doi.org/10.1016/j.pcrj.2006.07.008
16. Llauger Roselló MA, Pou MA, Domínguez L, Freixas M, Valverde P, Valero C, et al. Treating COPD in chronic patients in a primary-care setting [Article in Spanish]. Arch Bronconeumol. 2011;47(11):561-70. PMid:22036593. http://dx.doi.org/10.1016/j.arbres.2011.10.001
17. Hill K, Goldstein RS, Guyatt GH, Blouin M, Tan WC, Davis LL, et al. Prevalence and underdiagnosis of chronic obstructive pulmonary disease among patients at risk in primary care. CMAJ. 2010;182(7):673-8. PMid:20371646 PMCid:2855915. http://dx.doi.org/10.1503/cmaj.091784
18. Geijer RM, Sachs AP, Hoes AW, Salomé PL, Lammers JW, Verheij TJ. Prevalence of undetected persistent airflow obstruction in male smokers 40-65 years old. Fam Pract. 2005;22(5):485-9. PMid:15964866. http://dx.doi.org/10.1093/fampra/cmi049
19. McIvor RA, Tashkin DP. Underdiagnosis of chronic obstructive pulmonary disease: a rationale for spirometry as a screening tool. Can Respir J. 2001;8(3):153-8. Pmid:11420591.
20. Hill K, Hodder R, Blouin M, Heels-Ansdell D, Guyatt G, Goldstein R. Identifying adults at risk of COPD who need confirmatory spirometry in primary care: Do symptom-based questions help? Can Fam Physician. 2011;57(2):e51-7. PMid:21642706 PMCid:3038833.
21. Siatkowska H, Kozielski J, Ziora D. Patients with chronic obstructive pulmonary disease in the primary care setting. Pneumonol Alergol Pol. 2010;78(2):112-20. Pmid:20306422.
22. Chapman KR, Tashkin DP, Pye DJ. Gender bias in the diagnosis of COPD. Chest. 2001;119(6):1691-5. PMid:11399692. http://dx.doi.org/10.1378/chest.119.6.1691
* Trabalho realizado na Universidade Federal de Goiás, Goiânia (GO) Brasil.
Endereço para correspondência: Maria Conceição C. A. M. de Queiroz. Serviço de Pneumologia, Hospital das Clínicas da UFG, Primeira Avenida, s/n, 2º andar, Setor Leste Universitário, CEP 746005-020, Goiânia, GO, Brasil.
Tel. 55 62 3093-4744. E-mail: sissibb@ig.com.br
Apoio financeiro: Este estudo recebeu apoio financeiro da Fundação de Amparo à Pesquisa do Estado de Goiás (FAPEG).
Submetido em 3/7/2012. Aprovado, após revisão, em 14/9/2012.
Sobre os autores
Maria Conceição de Castro Antonelli Monteiro de Queiroz
Médica Assistente. Serviço de Pneumologia, Hospital das Clínicas, Faculdade de Medicina, Universidade Federal de Goiás,
Goiânia (GO) Brasil.
Maria Auxiliadora Carmo Moreira
Professora Associada. Faculdade de Medicina, Universidade Federal de Goiás, Goiânia (GO) Brasil.
Marcelo Fouad Rabahi
Professor Adjunto. Faculdade de Medicina, Universidade Federal de Goiás, Goiânia (GO) Brasil.







