Luciana Gomes Menezes, Juliana Alves Uzuelli, Cristiane Tefé-Silva, Simone Gusmão Ramos, José Eduardo Tanus dos Santos, José Antônio Baddini Martinez
RESUMO
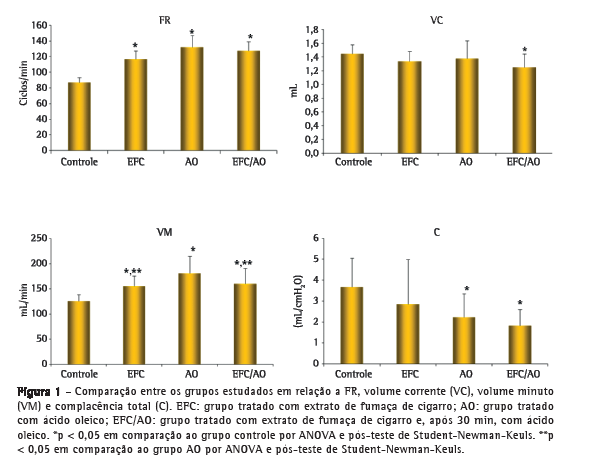
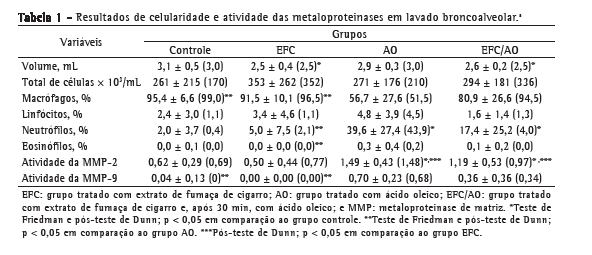
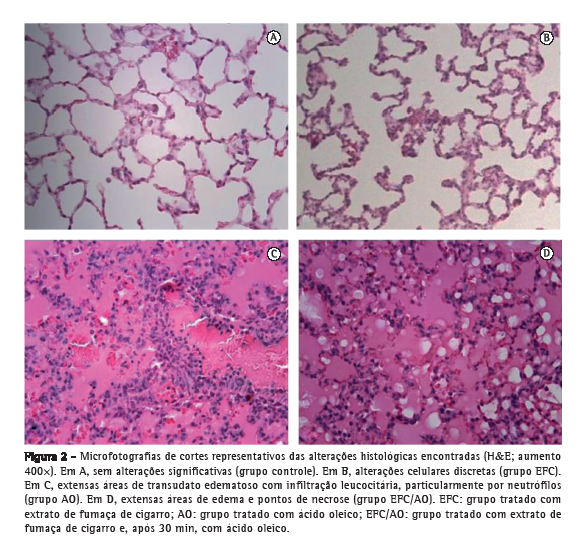
Objetivo: Investigar os efeitos agudos da administração endovenosa de extrato da fumaça do cigarro (EFC) em parâmetros funcionais respiratórios, inflamatórios e histológicos em ratos e comparar esse potencial modelo de lesão pulmonar aguda (LPA) com aquele com o uso de ácido oleico (AO). Métodos: Foram estudados 72 ratos Wistar machos divididos em quatro grupos: tratados somente com soro fisiológico (SF; grupo controle); tratados com EFC e SF (grupo EFC); tratados com SF e AO (grupo AO); e tratados com EFC e AO (grupo EFC/AO). Resultados: As médias de complacência foram significantemente menores nos grupos AO e EFC/AO (2,12 ± 1,13 mL/cmH2O e 1,82 ± 0,77 mL/cmH2O, respectivamente) do que no controle (3,67 ± 1,38 mL/cmH2O). A proporção de neutrófilos e a atividade das metaloproteinases 2 e 9 em lavado broncoalveolar foram significantemente maiores nos grupos AO e EFC/AO que no controle. O acometimento pulmonar avaliado por morfometria foi significantemente maior nos grupos AO e EFC/AO (72,9 ± 13,8% e 77,6 ± 18,0%, respectivamente) do que nos grupos controle e EFC (8,7 ± 4,1% e 32,7 ± 13,1%, respectivamente), e esse acometimento foi significantemente maior no grupo EFC que no grupo controle. Conclusões: A administração endovenosa de EFC, nas doses e tempos deste estudo, associou-se à LPA mínima. O EFC não potencializou a LPA induzida por AO. Estudos adicionais são necessários para esclarecer o papel potencial desse modelo como método de estudo dos mecanismos de agressão pulmonar pelo tabaco.
Palavras-chave: Tabagismo; Lesão pulmonar aguda; Modelos animais.
Introdução