ABSTRACT
We report the case of a child with tetraplegia after cervical trauma, who subsequently underwent diaphragmatic pacemaker implantation. We reviewed the major indications for diaphragmatic pacing and the types of devices employed. We highlight the unequivocal benefit of diaphragmatic pacing in the social and educational reintegration of individuals with tetraplegia.
Keywords:
Spinal cord injuries; Respiration, artificial; Pacemaker, artificial; Quadriplegia.
RESUMO
Relatamos o caso de uma criança tetraplégica após trauma cervical que foi posteriormente submetida a implante de marca-passo diafragmático. Revisamos as principais indicações da estimulação diafragmática e os tipos de dispositivos empregados, assim como apontamos o inequívoco benefício da reinserção socioeducacional desses indivíduos na sociedade.
Palavras-chave:
Traumatismos da medula espinal; Respiração artificial; Marca-passo artificial; Quadriplegia.
IntroduçãoO termo genérico "marca-passo diafragmático" (MPD) designa um dispositivo que gera impulsos elétricos junto ao nervo frênico para provocar contrações diafragmáticas que visam substituir a ventilação mecânica em pacientes com insuficiência respiratória. A condição essencial para que essa terapêutica possa ser empregada é que o nervo frênico esteja preservado.
A estimulação elétrica do nervo frênico foi descrita há 200 anos, e, desde então, essa terapêutica tem sido investigada em diversas condições, tais como asfixia, cólera, pólio e apneia. (1) Entretanto, o uso clínico do MPD só ocorreu nas últimas décadas a partir do estudo de Glenn e Phelps, que realizaram o implante de um MPD em pacientes com trauma raquimedular e síndrome da hipoventilação central congênita. (2,3) Desde então, muitos avanços foram obtidos na também chamada ventilação elétrica(4) ou eletrofrênica.(5)
Existem dois tipos de dispositivos para a estimulação do nervo frênico, dependendo do local de implante: diretamente no nervo frênico ou diretamente no diafragma. Os marca-passos conectados ao nervo frênico podem ser implantados ao longo do nervo por via cervical ou torácica. O nervo frênico se origina nas raízes nos níveis C3 e C4, com a junção da raiz em C5 mais distalmente. Com o implante cervical, corre-se o risco de o eletrodo ser posicionado no nervo antes da junção da raiz em C5. A presença de traqueostomia pode aumentar o risco de infecção. (6) Por esses motivos, recomenda-se que o implante seja realizado no segmento intratorácico do nervo frênico, preferencialmente por videocirurgia.
Além do implante dos eletrodos em torno do nervo frênico, também é necessário se criar uma loja subcutânea para acomodar uma extensão metálica do eletrodo.
No mercado mundial, há dois modelos de marca-passos frênicos: Mark IV® (Avery Biomedical Devices, Commack, NY, EUA), que é monopolar (Figura 1),(7) e Atrostim® (Atrotech, Tampere, Finlândia), de tecnologia quadripolar.(8,9)

Outro dispositivo desenvolvido mais recentemente é o MPD propriamente dito, NeuRx® (Synapse Biomedical, Oberlin, OH, EUA). (10,11) Esse dispositivo é implantado diretamente na placa motora do diafragma por meio de videolaparoscopia. Embora tenha a vantagem teórica de poder ser implantado por via única, esse dispositivo apresenta uma desvantagem: seus eletrodos permanecem exteriorizados através da pele do paciente.
Esses tipos de marca-passo têm sido utilizados em três grupos de pacientes. A indicação clássica é nos casos de insuficiência respiratória após trauma raquimedular ou por lesões centrais decorrentes de tumores ou acidentes vasculares cerebrais. Outra indicação é na síndrome da hipoventilação central congênita (síndrome de Ondine),(12) principalmente nos pacientes que são dependentes de ventilação mecânica em tempo integral, de forma que essas crianças possam ganhar mobilidade durante o período diurno. Finalmente, uma indicação ainda não totalmente estabelecida é na esclerose lateral amiotrófica, na expectativa de que o MPD possa retardar a instalação da insuficiência respiratória.(13)
Considerando que a ventilação elétrica em nosso meio ainda é incipiente, o objetivo do presente estudo foi relatar um caso de implante de MPD em uma criança vítima de trauma raquimedular, não só para demonstrar os benefícios alcançados por essa opção terapêutica (fundamentalmente, a reintegração social e a facilidade técnica do implante por videocirurgia), mas também demonstrar que o MPD pode ser manipulado sem dificuldades mesmo fora de ambiente hospitalar.
Relato de casoPaciente do sexo masculino de cinco anos de idade, procedente do município de Caxias do Sul (RS), com história pregressa de atropelamento (em janeiro de 2010) e fratura da coluna cervical alta, em nível C3/C4. A lesão medular foi confirmada por TC axial com reconstrução tridimensional.
O paciente foi submetido a alinhamento e fixação cirúrgica das vértebras correspondentes. Evoluiu com tetraplegia e insuficiência respiratória com dependência total de ventilação mecânica, acompanhada de traqueostomia, gastrostomia e cistostomia. Além das circunstâncias clínicas, o isolamento social foi determinante para a reação dos familiares em buscar auxílio. Nas redes sociais, o sofrimento foi dividido com outros pacientes que padeciam da mesma situação.
Em abril de 2013, houve a indicação de implante de marca-passo frênico. A avaliação pré-operatória incluiu exames hematológicos de rotina, gasometria arterial e radiografia de tórax. A eletroneuromiografia do nervo frênico foi solicitada para avaliar a viabilidade funcional do nervo, que poderia estar comprometida por isquemia traumática, assim como determinar se havia integridade do nervo frênico/diafragma, condição essencial para se prosseguir com o implante. A eletroneuromiografia demonstrou condução neural adequada, com boa resposta do músculo diafragma à estimulação elétrica transcutânea cervical.
O procedimento cirúrgico para o implante do dispositivo foi conduzido pela equipe do Serviço de Cirurgia Torácica do Hospital Geral da Fundação Universidade de Caxias do Sul, em Caxias do Sul.
Devido às condições clínicas peculiares do paciente, o ato anestésico e cirúrgico demandou cuidados que não são os habituais em pacientes jovens.(14) O paciente foi submetido à anestesia geral, por meio de sonda traqueal introduzida pelo traqueostoma, com o auxílio de broncoscopia para se obter ventilação unilateral durante o procedimento. Em decúbito lateral, um trocarte de 10 mm foi inserido no 6º espaço intercostal na linha axilar média, para a introdução de uma fibra óptica de 30°. Uma minitoracotomia de trabalho (3 cm) foi realizada na linha axilar anterior no 4º espaço intercostal para a inserção dos componentes do sistema Mark IV® e dissecção do nervo frênico.
Por sobre o pericárdio, o nervo foi cuidadosamente dissecado para evitar sua ruptura ou isquemia, numa extensão mínima o suficiente para que o eletrodo pudesse "abraçar" o nervo sem causar tração ou compressão excessivas (Figura 2). A partir desse momento, o sistema foi conectado, e realizou-se a estimulação teste in vivo para a confirmação da contração diafragmática (Figura 3).
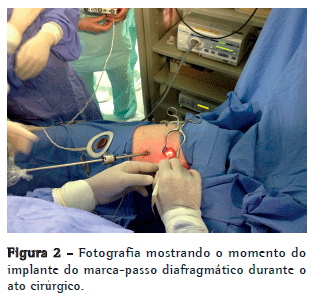
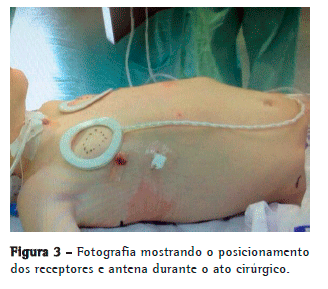
A partir da minitoracotomia, por sobre o músculo peitoral maior, foi confeccionado um túnel para criar uma loja subcutânea que abrigou o receptor do dispositivo, ligado ao eletrodo implantado no nervo frênico. O sistema foi novamente testado, sob visão direta de videotoracoscopia, com diferentes voltagens, definindo-se àquela que produzia uma contração o mais isometricamente possível de forma bilateral. O pneumotórax residual foi evacuado por manobras de Valsalva, sem a necessidade de drenagem da cavidade pleural (Figura 3).
A possibilidade de realizar o procedimento por videocirurgia reduziu a morbidade e acelerou a recuperação pós-operatória. O procedimento não apresentou intercorrências, e o paciente recebeu alta hospitalar no 3° dia pós-operatório.
Como o uso da ventilação mecânica provoca atrofia do diafragma com conversão de fibras lentas do tipo I para fibras rápidas do tipo IIb,(15) decorridas três semanas, período requerido para a cicatrização das feridas operatórias e para a diminuição do edema na interface do nervo e eletrodo, foi iniciado o período de estimulação com o MPD para o condicionamento do diafragma.
DiscussãoEmbora a ventilação mecânica seja o fator mantenedor da vida nos pacientes vítimas de trauma raquimedular alto, ela também apresenta características negativas, como atrofia diafragmática, barotraumas, estigmas da traqueostomia e de tubos, dificuldades com a fala, perda do olfato, etc. Além disso, a má ventilação dos segmentos pulmonares posteriores, a drenagem ciliar deficitária e o excesso de secreção acumulada acarretam infecções respiratórias frequentes, que se constituem como a principal causa de mortalidade nesses pacientes.(16)
A transição do ventilador para o MPD exige uma progressão sistemática, tanto para a criança adaptar-se da forma mais fisiológica e confortável possível, quanto para o cuidador, que deve estar habilitado para identificar os sinais de esforço e fadiga ventilatória. A família da criança recebeu o treinamento para o reconhecimento desses sinais e rapidamente mostrou-se habilitada a manusear o dispositivo.
O fechamento da cânula de traqueostomia e a sensação da contração muscular diafragmática provocavam desconforto e ansiedade, mas esses sintomas foram sendo trabalhados e melhorados a cada sessão de uso do equipamento pela própria família.
É sabido que, na estimulação do diafragma com MPD, existe uma relação entre estimulações realizadas com altas frequências e fadiga/degeneração neural. Inicialmente, a estimulação ocorreu em baixas frequências (< 10 Hz) e com FR entre 12 e 15 ciclos/min. Dessa forma, a permanência fora do ventilador começou com sessões de cinco minutos diárias, sendo elevada dia a dia.
Pacientes traqueostomizados sob ventilação mecânica apresentam perda olfatória, que prejudica a distinção e o gosto dos alimentos devido ao desvio do fluxo de ar provocado pela pressão positiva. Após o início da ventilação com o MPD, o paciente readquiriu sua função olfatória, o que também representou ganho na qualidade de vida.(17)
A dependência da ventilação mecânica e a consequente redução da mobilidade, que leva ao isolamento social, são fatores a se considerar, principalmente porque, em geral, os pacientes são jovens, previamente hígidos, abruptamente retirados de sua vida autônoma. O trauma psicológico e a desesperança se instalam e constituem pontos que precisam ser trabalhados por uma equipe especializada. Nesse cenário, a retomada do convívio social e educacional é a consequência mais festejada do procedimento.
Desde a alta hospitalar até o momento da redação do presente relato, o paciente encontrava-se em sua residência, onde dispõe de cuidados assistenciais por uma equipe multidisciplinar, já havendo regressado para as aulas regulares em sua escola, frequentando cinemas e realizando passeios com amigos e familiares.
Transcorrido mais de um ano do procedimento, a criança já permanecia livre da ventilação mecânica por períodos superiores a 10 h ininterruptas, mantendo um padrão ventilatório satisfatório (volume corrente = 277 mL; FR = 18 ciclos/min; e SpO2 = 97%). Há a possibilidade de utilização do MPD em tempo integral.(18)
Apesar de ser uma tecnologia ainda cara em nosso meio, o MPD encontra-se disponível, e a indústria e as pesquisas médicas apontam para o crescimento da oferta e da qualidade das opções de dispositivos.
Por fim, a possibilidade de prescindir da ventilação mecânica, mesmo que de maneira intermitente, permitindo a reinserção desses indivíduos na sociedade, além da sua inclusão em programas mais eficazes de reabilitação e do regresso à vida escolar ou laboral, são a essência dessa indicação terapêutica.
Referências1. Glenn WW, Phelps ML. Diaphragm pacing by electrical stimulation of the phrenic nerve. Neurosurgery. 1985;17(6):974-84. http://dx.doi.org/10.1227/00006123-198512000-00021
2. Glenn WW, Holcomb WG, Gee JB, Rath R. Central hypoventilation; long-term ventilatory assistance by radiofrequency electrophrenic respiration. Ann Surg. 1970;172(4):755-73. http://dx.doi.org/10.1097/00000658-197010000-00020
3. Glenn WW, Holcomb WG, McLaughlin AJ, O'Hare JM, Hogan JF, Yasuda R. Total ventilatory support in a quadriplegic patient with radiofrequency electrophrenic respiration. N Engl J Med. 1972;286(10):513-6. http://dx.doi.org/10.1056/NEJM197203092861004
4. Tedde ML, Onders RP, Teixeira MJ, Lage SG, Ballester G, Brotto MW, et al. Electric ventilation: indications for and technical aspects of diaphragm pacing stimulation surgical implantation. J Bras Pneumol. 2012;38(5):566-72. http://dx.doi.org/10.1590/S1806-37132012000500005
5. Stonnington HH. Electrophrenic respiration. Mayo Clin Proc. 1979;54(10):690.
6. Sardenberg RA, Secaf LB, Pinotti AC, Taricco MA, Brock RS, Younes RN. Diaphragmatic Pacing: unusual indication with successful application. J Bras Pneumol. 2011;37(5):697-9. http://dx.doi.org/10.1590/S1806-37132011000500020
7. Khong P, Lazzaro A, Mobbs R. Phrenic nerve stimulation: the Australian experience. J Clin Neurosci. 2010;17(2)205-8. http://dx.doi.org/10.1016/j.jocn.2009.06.012
8. Le Pimpec-Barthes F, Gonzalez-Bermejo J, Hubsch JP, Duguet A, Morélot-Panzini C, Riquet M, et al. Intrathoracic phrenic pacing: a 10-year experience in France. J Thorac Cardiovasc Surg. 2011;142(2):378-83. http://dx.doi.org/10.1016/j.jtcvs.2011.04.033
9. Hirschfeld S, Vieweg H, Schulz AP, Thietje R, Baer GA. Threshold currents of platinum electrodes used for functional electrical stimulation of the phrenic nerves for treatment of central apnea. Pacing Clin Electrophysiol. 2013;36(6):714-8. http://dx.doi.org/10.1111/pace.12073
10. Onders RP, Dimarco AF, Ignagni AR, Aiyar H, Mortimer JT. Mapping the phrenic nerve motor point: the key to a successful laparoscopic diaphragm pacing system in the first human series. Surgery. 2004;136(4):819-26. http://dx.doi.org/10.1016/j.surg.2004.06.030
11. Onders RP. Phrenic nerve and diaphragm motor point pacing. In: Patterson GA, Pearson FG, Cooper JD, Deslauriers J, Rice TW, Luketich JD, et al. editors. Pearson's Thoracic and Esophageal Surgery. 3rd ed. Philadelphia, PA: Churchill Livingstone Elsevier; 2008. p. 1445-57. http://dx.doi.org/10.1016/B978-0-443-06861-4.50123-4
12. Weese-Mayer DE, Berry-Kravis EM, Ceccherini I, Keens TG, Loghmanee DA, Trang H; et al. An official ATS clinical policy statement: Congenital central hypoventilation syndrome: genetic basis, diagnosis, and management. Am J Respir Crit Care Med. 2010;181(6):626-44. http://dx.doi.org/10.1164/rccm.200807-1069ST
13. Onders RP, Elmo M, Kaplan C, Katirji B, Schilz R. Final analysis of the pilot trial of diaphragm pacing in amyotrophic lateral sclerosis with long-term follow-up: diaphragm pacing positively affects diaphragm respiration. Am J Surg. 2014;207(3):393-7. discussion 397.
14. Tedde ML, Vasconcelos Filho P, Hajjar LA, de Almeida JP, Flora GF, Okumura EM, et al. Diaphragmatic pacing stimulation in spinal cord injury: anesthetic and perioperative management. Clinics (Sao Paulo). 2012;67(11):1265-9 http://dx.doi.org/10.6061/clinics/2012(11)07
15. Ayas NT, McCool FD, Gore R, Lieberman SL, Brown R. Prevention of human diaphragm atrophy with short periods of electrical stimulation. Am J Respir Crit Care Med. 1999;159(6):2018-20. http://dx.doi.org/10.1164/ajrccm.159.6.9806147
16. University of Alabama at Birmighan. National Spinal Cord Injury Statistical Center [homepage on the Internet] Birminghan: NSCISC. [cited 2012 Nov 30]. 2012 Annual Report Complete Public Version. [Adobe Acrobat document, 104p. https://www.nscisc.uab.edu/PublicDocuments/reports/pdf/2012%20NSCISC%20Annual%20Statistical%20Report%20Complete%20Public%20Version.pdf
17. Adler D, J. Gonzalez-Bermejo J, Duguet A, Demoule A, Le Pimpec-Barthes F, Hurbault A, et al. Diaphragm pacing restores olfaction in tetraplegia. Eur Respir J. 2009;34(2):365-70. http://dx.doi.org/10.1183/09031936.00177708
18. Glenn WW, Holcomb WG, Shaw RK, Hogan JF, Holschuh KR. Long-term ventilatory support by diaphragm pacing in quadriplegia. Ann Surg. 1976;183(5):566-77. http://dx.doi.org/10.1097/00000658-197605000-00014
*Trabalho realizado no Hospital Geral de Caxias do Sul, Fundação Universidade de Caxias do Sul, Caxias do Sul (RS) Brasil.
Endereço para correspondência: Darcy Ribeiro Pinto Filho. Hospital Geral de Caxias do Sul, Avenida Professor Antônio Vignolli, 255, Petrópolis, CEP 95070-561, Caxias do Sul, RS, Brasil.
Tel/fax: 55 54 3218-7200, ramal 240. E-mail: darcyrp@terra.com.br
Apoio financeiro: Nenhum.
Recebido para publicação em 26/5/2014. Aprovado, após revisão, em 4/9/2014.
Sobre os autoresDarcy Ribeiro Pinto Filho
Chefe. Serviço de Cirurgia Torácica, Hospital Geral de Caxias do Sul, Fundação Universidade de Caxias do Sul, Caxias do Sul (RS) Brasil.
Miguel Lia Tedde
Cirurgião Torácico. Departamento de Cirurgia Torácica, Instituto do Coração, Hospital das Clínicas, Faculdade de Medicina,
Universidade de São Paulo, São Paulo (SP) Brasil.
Alexandre José Gonçalves Avino
Cirurgião Torácico Associado. Serviço de Cirurgia Torácica, Hospital Geral de Caxias do Sul, Fundação Universidade de Caxias
do Sul, Caxias do Sul (RS) Brasil.
Suzan Lúcia Brancher Brandão
Cirurgiã Torácica Associada. Serviço de Cirurgia Torácica, Hospital Geral de Caxias do Sul, Fundação Universidade de Caxias do
Sul, Caxias do Sul (RS) Brasil.
Iuri Zanatta
Cirurgião Geral. Hospital Geral de Caxias do Sul, Fundação Universidade Caxias do Sul, Caxias do Sul (RS) Brasil.
Rafael Hahn
Cirurgião Geral. Hospital Geral de Caxias do Sul, Fundação Universidade Caxias do Sul, Caxias do Sul (RS) Brasil.






