Ao Editor:A tuberculose cutânea (TBC) continua a ser um dos diagnósticos mais difíceis de fazer em virtude das grandes variações em sua aparência clínica, histopatologia, imunologia e resposta ao tratamento.(1,2) A incidência da TBC tem aumentado no século XXI, em virtude da alta incidência de infecção por HIV e tuberculose pulmonar multirresistente.(3,4)
Embora a TBC corresponda a apenas 1,5% de todos os casos de tuberculose extrapulmonar e 0,15% de todos os casos de doença cutânea, esses números são significativos porque a prevalência da tuberculose é alta em muitos países.(1,2) Mycobacterium tuberculosis, M. bovis e a vacina BCG podem causar TBC.(5)
Na maioria dos casos, a tuberculose é transmitida por via aérea, e manifestações cutâneas resultam de disseminação hematogênica ou são uma extensão direta de um foco de infecção. No entanto, a inoculação primária pode ocorrer por introdução direta das micobactérias na pele ou mucosa de um indivíduo suscetível por meio de trauma ou lesão. O risco aumenta na presença de infecção pelo HIV, abuso de drogas intravenosas, diabetes mellitus, terapia imunossupressora, malignidade, doença renal terminal ou lactância.(5,6) Embora seja um sinal raro, a TBC deve ser considerada no diagnóstico diferencial de lesões cutâneas, especialmente em indivíduos com história de tuberculose.
Um homem de 68 anos de idade apresentava perda de peso e astenia havia seis meses. Tratava-se de um operário aposentado e ex-fumante, com história de tuberculose pulmonar em sua juventude (dois episódios distintos, com 20 anos decorridos entre um e outro e regimes terapêuticos desconhecidos), esquizofrenia, doença osteoarticular e esofagite de refluxo. O paciente apresentava também dois inchaços cutâneos torácicos anteriores (22 × 60 cm e 80 x 30 cm, respectivamente) que eram dolorosos à palpação, com consistência elástica e sem calor local na pele sobrejacente (Figura 1). Ele relatou que os inchaços apareceram pela primeira vez um mês antes. Não referiu febre nem apresentou queixas respiratórias. Não foram detectados linfonodos. A TC de tórax revelou duas coleções líquidas na parede torácica anterior, com aspecto distrófico, bem como espessamento do arco costal e da cartilagem costal adjacente.

Diagnósticos como abscesso estafilocócico, infecção bacteriana mista, nocardiose, infecções por micobactérias atípicas e infecções fúngicas profundas foram considerados. A biópsia de um dos inchaços revelou tecido de granulação com linfócitos, plasmócitos e histiócitos, com áreas supurativas e um trajeto fistuloso. Em esfregaços de escarro, a coloração para BAAR foi negativa, embora a PCR de uma amostra de escarro tenha sido positiva para M. tuberculosis. A sorologia para HIV foi negativa. O paciente foi encaminhado a um centro para o tratamento de doenças do tórax, para avaliação e tratamento.
Outra TC do parênquima pulmonar revelou algumas alterações fibróticas em ambos os ápices pulmonares. Os resultados da baciloscopia do escarro para pesquisa de BAAR foram novamente negativos, embora a cultura da amostra obtida por meio da biópsia tivesse sido positiva para M. tuberculosis. O teste de sensibilidade aos fármacos mostrou que a cepa era sensível a isoniazida e rifampicina, bem como a todos os tuberculostáticos de primeira linha testados.
O paciente passou a receber quatro tuberculostáticos, cujas doses foram ajustadas de acordo com seu peso corporal: isoniazida (300 mg/dia); rifampicina (600 mg/dia); pirazinamida (1.500 mg/dia) e etambutol (1.000 mg/dia). Solicitou-se uma avaliação psiquiátrica para que o regime terapêutico levasse em conta a esquizofrenia. Após dois meses de tratamento, o regime terapêutico foi reduzido a dois medicamentos: isoniazida (300 mg/dia) e rifampicina (600 mg/dia). O paciente já completou seis meses de tratamento sem grandes efeitos colaterais, e as lesões cutâneas melhoraram (Figura 1).
A descrição da TBC inclui manifestações dermatológicas da tuberculose envolvendo a pele, e as primeiras classificações da doença baseavam-se na morfologia das lesões.(1,3,5) Em patentes com TBC, as lesões cutâneas caracterizam-se por inflamação granulomatosa, graus variados de necrose e graus variados de vasculite; M. tuberculosis é identificada por meio de coloração especial, cultura ou PCR.(3,5,6)
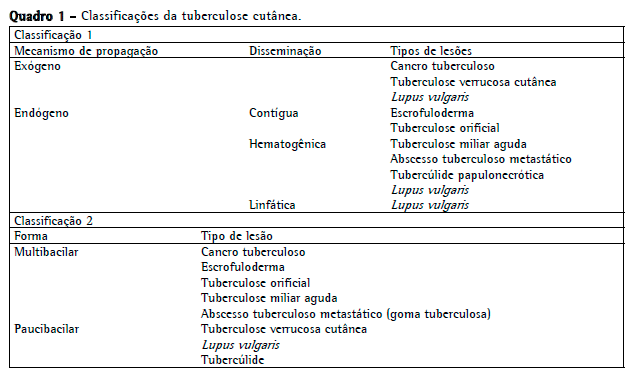
Embora sejam clinicamente semelhantes, lesões individuais de TBC podem ter desenvolvimento, progressão e prognóstico distintos. Com base nesse conhecimento, Tappeiner & Wolff propuseram o sistema de classificação de TBC mais amplamente aceito, que se baseia no mecanismo de propagação: disseminação exógena ou endógena.(3,5) A inoculação exógena ocorre após a inoculação direta de M. tuberculosis na pele de uma pessoa suscetível a infecção. A infecção endógena ocorre em pacientes previamente infectados. A transmissão exógena é significativamente menos comum.(5) Depois dessa primeira classificação, outros autores introduziram o conceito de carga bacteriana, a qual é usada para distinguir a forma multibacilar (em que as micobactérias são facilmente identificadas no exame histológico) da forma paucibacilar (em que o isolamento de micobactérias em cultura é raro).(1,3,5) O Quadro 1 resume esses dois sistemas de classificação.
Relatamos aqui o caso de um paciente que recebeu diagnóstico de abscesso tuberculoso metastático, também conhecido como goma tuberculosa, que geralmente ocorre em virtude de disseminação hematogênica de micobactérias que permanecem latentes até que, por algum motivo (imunossupressão ou desnutrição, por exemplo), a infecção se manifeste; no caso aqui relatado, é provável que a desnutrição tenha sido o gatilho. Essa forma de TBC é caracterizada por abscessos subcutâneos não tenros e flutuantes, que aparecem como lesões únicas ou múltiplas no tronco, nas extremidades ou na cabeça, as quais frequentemente invadem a pele e se rompem.
Embora nem sempre seja fácil fazer um diagnóstico clínico de TBC, a doença deve ser considerada em todos os casos de lesões cutâneas crônicas, principalmente em pacientes infectados pelo HIV e em pacientes com história de tuberculose pulmonar.(6) O diagnóstico diferencial inclui abscesso estafilocócico, outras infecções bacterianas mistas, esporotricose, nocardiose, cromomicose, leishmaniose, infecções por micobactérias atípicas, infecções fúngicas profundas, goma sifilítica, lepra e todas as formas de paniculite.(2)
Dentre as evidências que comprovam a apresentação clínica estão dados epidemiológicos, história de tuberculose ou contato com um paciente com tuberculose e histologia (biópsia de pele, na maioria dos casos). A histologia deve incluir baciloscopia de escarro para pesquisa de BAAR, PCR e cultura para M. tuberculosis.(1-3,5,6) O isolamento de M. tuberculosis em cultura é a única maneira de fazer um diagnóstico definitivo.
A goma tuberculosa é uma forma multibacilar de TBC que pode ocorrer sem qualquer fonte subjacente de tuberculose. A histologia de lesões de TBC revela necrose maciça e formação de abscesso. A coloração para BAAR geralmente mostra grandes quantidades de micobactérias.(1,3)
Os regimes terapêuticos usados no tratamento da tuberculose pulmonar são adequados para o tratamento da TBC, pois a carga bacilar é geralmente muito menor na TBC do que na tuberculose pulmonar.(3,7,8) Isso inclui regimes de tratamento diretamente observado, e o regime-padrão envolve dois meses de terapia quádrupla (isoniazida, rifampicina, pirazinamida e etambutol), seguidos de quatro meses de terapia dupla (isoniazida e rifampicina).(1)
É muito importante que se determine a história de tuberculose, pois os pacientes com história de tuberculose são mais suscetíveis a infecção por uma cepa de micobactéria resistente a tuberculostáticos. No caso aqui apresentado, a cultura do espécime obtido por meio de biópsia apresentou resultado positivo para M. tuberculosis, e o teste de sensibilidade aos fármacos mostrou sensibilidade a todos os medicamentos de primeira linha testados. A excisão cirúrgica é às vezes necessária, não só como método diagnóstico, mas também como adjuvante à terapia farmacológica. (4) Espera-se uma resposta clínica entre a quarta e a sexta semana de tratamento,(1) como no caso aqui relatado.
Apesar de incomum, a TBC deve ser considerada no diagnóstico diferencial de lesões cutâneas.
Referências1. Bravo FG, Gotuzzo E. Cutaneous tuberculosis. Clin Dermatol. 2007;25(2):173-80. http://dx.doi.org/10.1016/j.clindermatol.2006.05.005
2. Ghosh S, Aggarwal K, Jain VK, Chauduri S, Ghosh E, Arshdeep. Tuberculosis verrucosa cutis presenting as diffuse plantar keratoderma: an unusual sight. Indian J Dermatol. 2014;59(1):80-1. http://dx.doi.org/10.4103/0019-5154.123511
3. Barbagallo J, Tager P, Ingleton R, Hirsch RJ, Weinberg JM. Cutaneous tuberculosis. Diagnosis and Treatment. Am J Clin Dermatol. 2002;3(5):319-28. http://dx.doi.org/10.2165/00128071-200203050-00004
4. Stop TB Partnership. World Health Organization. The Global Plan to Stop TB 2011-2015: Transforming the fight towards elimination of tuberculosis. Geneva: Stop TB Partnership; 2010.
5. Frankel A, Penrose C, Emer J. Cutaneous Tuberculosis, a practical case report and review for the dermatologist. J Clin Aesthet Dermatol. 2009;2(10):19-27.
6. Black O. A facial lesion . the face of cutaneous tuberculosis. S Sudan Med J. 2013;6(2):42-4.
7. Rama Rao GR; Sridevi, Narayan BL, Amareswar A, Sandhya S. Directly observed treatment short course and cutaneous tuberculosis: our experience. Indian J Dermatol Venereol Leprol. 2011;77(3):330-2. http://dx.doi.org/10.4103/0378-6323.79713
8. Yew WW, Lange C, Leung CC. Treatment of tuberculosis: update 2010. Eur Respir J. 2011;37(2):441-62. http://dx.doi.org/10.1183/09031936.00033010





