ABSTRACT
Objective: To describe the clinical manifestations of patients with pulmonary infection caused by mycobacteria of the Mycobacterium abscessus complex (MABSC), and to compare these manifestations with those of patients infected with other nontuberculous mycobacteria (NTM). Methods: This was a retrospective cohort study involving 43 patients divided into two groups: the MABSC group, consisting of patients with pulmonary infection caused by MABSC (n = 17); and the NTM group, consisting of patients with pulmonary infection caused by NTM other than MABSC (n = 26). Patients were previously treated with a regimen of rifampin, isoniazid, pyrazinamide, and ethambutol before the diagnosis of NTM was confirmed by two culture-positive sputum samples. The nucleotide sequences of the hsp65, 16S rRNA, and/or rpoB genes were analyzed to identify the mycobacteria. Data were collected on demographic, clinical, and radiological characteristics, as well as on treatment responses and outcomes. Results: Loss of appetite was the only clinical manifestation that was significantly more common in the MABSC group than in the NTM group (p = 0.0306). The chance of having to use a second treatment regimen was almost 12 times higher in the MABSC group than in the NTM group. Treatment success was significantly higher in the NTM group than in the MABSC group (83.2% vs. 17.6%; p < 0.0001). The chance of recurrence was approximately 37 times higher in the MABSC group than in the NTM group. Conclusions: In the study sample, treatment response of pulmonary disease caused by MABSC was less favorable than that of pulmonary disease caused by other NTM.
Keywords:
Nontuberculous mycobacteria/classification; Nontuberculous mycobacteria/drug effects; Lung diseases.
RESUMO
Objetivo: Descrever as manifestações clínicas de pacientes com infecção pulmonar por micobactérias do complexo Mycobacterium abscessus (CMA) e compará-las com as daqueles infectados com outras micobactérias não tuberculosas (MNT). Métodos: Estudo de coorte retrospectivo envolvendo 43 pacientes divididos em dois grupos: grupo CMA, com pacientes com infecção pulmonar por CMA (n = 17); e grupo MNT, com pacientes com infecção pulmonar por MNT que não CMA (n = 26). Os pacientes foram previamente tratados com o esquema rifampicina, isoniazida, pirazinamida e etambutol antes de o diagnóstico de MNT ser confirmado com culturas positivas em duas amostras de escarro diferentes. As sequências nucleotídicas dos genes hsp65, RNAr 16S e/ou rpoB foram analisadas para a identificação das micobactérias. Foram coletadas características demográficas, clínicas e radiológicas, assim como respostas terapêuticas e desfechos. Resultados: A única manifestação clínica significativamente mais frequente no grupo CMA que no grupo MNT foi hiporexia (p = 0,0306). A chance de haver a necessidade de utilização de um segundo esquema terapêutico foi quase 12 vezes maior no grupo CMA que no grupo MNT. O sucesso terapêutico foi significativamente maior no grupo MNT que no grupo CMA (83,2% vs. 17,6%; p < 0,0001). A chance de recidiva no grupo CMA foi aproximadamente 37 vezes maior que no grupo MNT. Conclusões: Na amostra estudada, a resposta terapêutica da doença pulmonar causada por CMA evoluiu de forma menos favorável do que naquela causada pelas demais MNT.
Palavras-chave:
Micobactérias não tuberculosas/classificação; Micobactérias não tuberculosas/efeitos de drogas; Pneumopatias.
INTRODUÇÃOAs micobactérias não tuberculosas (MNT) compreendem o grupo de microorganismos que diferem do Mycobacterium tuberculosis e M. leprae. São hoje documentadas mais de 100 espécies de crescimento rápido ou lento, patogênicas ou não, sendo muitas espécies saprófitas ambientais e algumas mais relacionadas a infecções oportunistas em imunodeprimidos.(1) O número de casos de infecções pulmonares por MNT vem emergindo em todo mundo, e os patógenos mais envolvidos são M. kansasii, M. abscessus e os membros do M. avium complex (MAC, complexo M. avium). O complexo M. abscessus (CMA) é caracterizado por micobactérias de crescimento rápido em meios de cultura, representadas pelas subespécies M. abscessus subsp. abscessus, M. abscessus subsp. massiliense e M. abscessus subsp. bolletii,(2) sendo a principal característica desse complexo a presença de genes indutores de resistência aos macrolídeos, cujo gene principalmente descrito é erm, exceto no caso da subespécie massiliense, o que causa grande dificuldade na resposta ao tratamento dos infectados.(3) Em casos de infecções pulmonares pelo CMA, os protocolos envolvem o uso de macrolídeos (claritromicina ou azitromicina), aminoglicosídeos (amicacina) e há esquemas com cefoxitina, imipenem e tigeciclina.(4) Dessa forma, os esquemas podem incluir até dois agentes de administração parenteral (amicacina, imipenem, tigeciclina ou cefoxitina) por um tempo prolongado (1 ano). O perfil dos pacientes mais acometidos pelas micobactérias do CMA não se diferencia do daqueles acometidos por outras micobactérias, cuja maioria é composta por mulheres de meia-idade e portadoras de alterações estruturais pulmonares (bronquiectasias).(5) Quanto à epidemiologia das MNT no Brasil, há diferentes prevalências regionais das espécies envolvidas. Em um recente levantamento avaliando a incidência de casos entre pacientes diagnosticados equivocadamente como tuberculose pulmonar, foi observado que 8% daqueles pacientes apresentavam outras micobactérias nos estados da Bahia, Piauí e Pará; em São Paulo, que compreendia a maior parte dos casos, 20% dos pacientes diagnosticados com tuberculose tinham na verdade MNT.(6,7) Sendo o Brasil um país de dimensões continentais, as diferenças demográficas devem ser consideradas, e a escassez de estudos brasileiros justifica novos estudos nessa área para a compreensão da história natural desses pacientes em um contexto regional.
MÉTODOSTrata-se de um estudo descritivo e analítico do tipo coorte retrospectiva, que utilizou dados de todos os pacientes com diagnóstico de infecção pulmonar por MNT acompanhados entre os anos de 2003 e 2013 no Ambulatório de MNT do Hospital Universitário João de Barros Barreto (HUJBB), localizado na cidade de Belém (PA), referência no atendimento de pacientes com tuberculose multirresistente e MNT no estado. A amostra foi caracterizada por conveniência. O projeto de pesquisa foi aprovado pelo Comitê de Ética do HUJBB (CAAE: 44731115.6.3001.0017). Os dados foram coletados de prontuários e questionários já registrados em consultas médicas mensais. A reavaliação dos pacientes foi realizada a partir de seis meses após o início do tratamento através de registros em fichas devidamente preenchidas, incluindo dados de avaliação clínica, bacteriológica (resultados de culturas) e radiológica (laudos radiológicos). Os critérios de inclusão foram apresentar diagnóstico clínico, radiológico e laboratorial - esse último confirmado com culturas positivas em duas amostras diferentes de escarro, de acordo com os critérios da American Thoracic Society (ATS) - de infecção pulmonar por MNT e ter assinado o termo de consentimento livre e esclarecido, sendo excluídos os casos em que foi isolado concomitantemente M. tuberculosis. A identificação da espécie e subespécie de micobactéria envolvida, realizada no Laboratório de Biologia Molecular do Instituto Evandro Chagas, foi efetuada por meio de análise das sequências nucleotídicas dos genes hsp65, RNAr 16S e/ou rpoB, dependendo da espécie isolada. Os participantes foram separados em dois grupos: grupo CMA, composto por 17 indivíduos com infecção pulmonar por membros do CMA, e grupo MNT, composto por 26 indivíduos com infecção pulmonar por MNT não pertencentes ao CMA. As variáveis estudadas foram categorizadas como demográficas, clínicas e radiológicas (em radiografia posteroanterior e/ou TCAR de tórax).
As respostas terapêuticas foram categorizadas após o uso dos esquemas disponíveis na instituição. Foram utilizados como primeiro esquema: claritromicina (500 mg i.v.; 12/12 h), etambutol (1.200 mg; 24/24 h) e rifampicina (600 mg v.o.; 24/24 h). No segundo esquema, foi acrescentada amicacina (500 mg i.m.; 3 vezes/semana) ou estreptomicina (1 g i.m.; 3 vezes/semana). No terceiro esquema, acrescentou-se imipenem (500 mg v.o.; 6/6 h). Para a avaliação dos desfechos, considerou-se a melhora clínica, com registro em prontuário, e os resultados de cultura classificados em negativação da cultura, persistência da positividade (permanência da positividade por pelo menos seis meses após o início do tratamento) e positividade após negativação inicial (nova positividade nas culturas por dois meses consecutivos após a negativação inicial). A melhora radiológica após radiografia ou TCAR de tórax após o tratamento definiu o critério de cura até 2007 (anterior aos protocolos da ATS de 2007). As características sociodemográficas e clínicas foram expressas sob a forma de médias e desvios-padrão, medianas e intervalos interquartis, assim como frequências absolutas e relativas, conforme a variável. As frequências de casos observados em cada grupo, de acordo com a espécie de MNT isolada, foram avaliadas pelo teste do qui-quadrado ou pelo teste G de aderência, enquanto a associação entre variáveis categóricas foi estimada pelo teste do qui-quadrado (ou G), complementado pela análise de resíduos ajustados, caso necessário. A razão de chances foi utilizada para mensurar a associação entre desfecho e condição. A diferença entre médias foi testada pelo teste t de Student. Todos os testes foram executados com o programa BioEstat 5.48, e resultados com p ≤ 0,05 foram considerados significativos.
RESULTADOSDos 43 pacientes incluídos no estudo, 17 (39,5%) pertenciam ao grupo CMA e 26 (60,5%) pertenciam ao grupo MNT. Os pacientes dos grupos CMA e MNT apresentaram médias de idade de 62,4 ± 13,7 anos (variação: 39-94 anos) e 56,2 ± 14,6 anos (variação: 23-81 anos), respectivamente, sem diferença significativa (p = 0,1715), assim como foram semelhantes as proporções entre homens (23,5% vs. 34,6%) e mulheres (76,5% vs. 65,4%) entre os dois grupos (p = 0,6640).
Quanto às manifestações clínicas, notou-se que, com exceção da hiporexia, que foi significativamente mais frequente no grupo CMA que no grupo MNT (p = 0,0306), todos os demais sintomas relatados ocorreram em proporções semelhantes entre os grupos (p > 0,05). Os pacientes dos dois grupos apresentaram proporções semelhantes de doenças prévias ao diagnóstico da infecção, sem associações significativas entre os grupos. Em relação aos hábitos de vida, notou-se uma maior frequência de fumantes ativos entre os pacientes do grupo MNT que no grupo CMA, assim como de fumantes passivos no grupo CMA que no grupo MNT (p < 0,01 para ambos; Tabela 1).
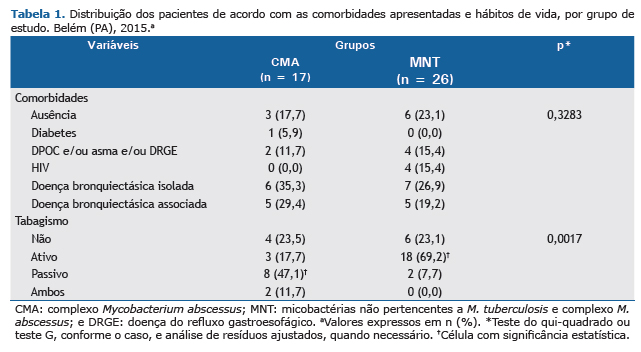
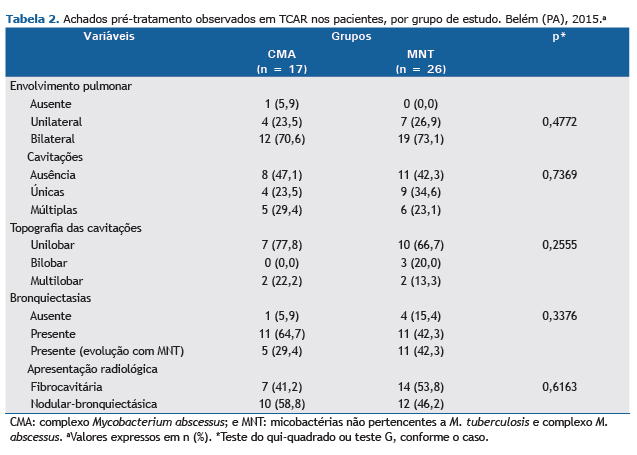
A Tabela 2 apresenta os achados radiológicos observados no diagnóstico de doença pulmonar por MNT, de acordo com os grupos estudados. Comparando os dois grupos, não houve diferenças estatisticamente significativas em relação a todas as variáveis estudadas.
Na amostra estudada, a chance de não adesão ao tratamento foi 10 vezes maior no grupo CMA que no grupo MNT (OR = 10,0; IC95%: 1,2-86,9). Quanto à resposta terapêutica, a proporção de pacientes do grupo CMA que não responderam ao primeiro esquema terapêutico foi significativamente maior que aquela de pacientes no grupo MNT (p = 0,0007), sendo necessário utilizar o segundo esquema de tratamento em 7 dos pacientes (41,2%) ou o terceiro esquema de tratamento em 4 dos pacientes (23,5%). No grupo MNT, entretanto, 20 dos 22 pacientes que concluíram o primeiro esquema de tratamento (83,2%) evoluíram para cura, e apenas 2 (9,0%) necessitaram iniciar o segundo esquema de tratamento (Tabela 3). Dessa forma, observou-se que a chance de haver a necessidade de se utilizar um segundo esquema terapêutico no grupo CMA foi quase 12 vezes maior do que no grupo MNT (OR = 11,70; IC95%: 1,9-71,8). Salientamos que nenhum paciente do grupo MNT precisou utilizar o terceiro esquema de tratamento (adição de imipenem). Em relação ao desfecho primário, houve uma frequência de recidiva significativamente maior no grupo CMA que no grupo MNT (p < 0,0001), sendo que a chance de recidiva foi aproximadamente 37 vezes maior no grupo CMA que no grupo MNT (OR = 36,7; IC95%: 5,3-253,8). Em contrapartida, ao avaliarmos os casos que evoluíram com melhora clínica e cura após o término do primeiro esquema de tratamento, essa proporção foi significativamente maior no grupo MNT que no grupo CMA (p < 0,0001). Esses dados sugerem que a doença pulmonar por CMA é mais agressiva e tem pior prognóstico que aquela produzida pelas demais MNT (Tabela 3). Salientamos que houve 2 óbitos no grupo MNT sem causa conhecida (não relacionada à infecção por MNT), e, por esse motivo, esses pacientes foram excluídos das comparações. Quanto ao desfecho secundário - obtido após o uso do segundo esquema ou após a administração desse em associação com o imipenem - 91,0% (10/11) dos pacientes do grupo CMA evoluíram para melhora clínica e cura, e 9,0% (1/11) evoluíram para óbito; o paciente que foi a óbito estava entre os pacientes que utilizaram o imipenem (terceiro esquema). Um dos pacientes com alta após o uso do segundo esquema associado a imipenem necessitou ser submetido a tratamento cirúrgico. Entre os pacientes do grupo TNM que realizaram o segundo esquema de tratamento (n = 2), ambos (100%) obtiveram sucesso terapêutico. No entanto, não houve diferenças estatisticamente significativas quanto a esses desfechos entre os grupos avaliados (p = 0,3917).
 DISCUSSÃO
DISCUSSÃOCom o número crescente de casos de infecções por MNT, vários estudos têm sido publicados com o objetivo de analisar essa situação clínica e epidemiológica.(8-10) Do total de casos incluídos no presente estudo, 39,5% tinham infecção por microrganismos pertencentes ao CMA, e 60,5% possuíam doença pulmonar ocasionada por outras MNT, sendo as mais prevalentes as do MAC. A prevalência de doença pulmonar por MAC e CMA está de acordo com levantamentos recentes nos EUA, onde a infecção por micobactérias do CMA só é menor que as do MAC, compreendendo de 2,6-13,0% de todos os casos de infecção pulmonar por MNT, com uma prevalência anual < 1/100.000 habitantes.(4) Quando considerada a doença pulmonar pelas subespécies do CMA, os dados encontrados foram semelhantes aos que descrevem que a proporção de casos de M. abscessus subsp. abscessus seria semelhante à da M. abscessus subsp. massiliense, enquanto a M. abscessus subsp. bolletii é raramente identificada. (4,11,12) Apontam-se como condições predisponentes ao adoecimento o tratamento anterior para tuberculose pulmonar e alterações estruturais pulmonares, sendo aqui representadas por bronquiectasias.(9,13,14) Em um estudo que comparou variáveis clínicas da doença pulmonar por M. abscessus subsp. massiliense e M. abscessus subsp. abscessus, não foram encontradas diferenças significativas,(15) ao contrário dos achados do presente estudo, no qual a hiporexia foi mais frequente entre os infectados por micobactérias do CMA. Com relação aos múltiplos tratamentos com o esquema rifampicina, isoniazida, pirazinamida e etambutol (RHZE) para tuberculose em pacientes com MNT, isso se deve a não realização obrigatória de culturas com identificação micobacteriana no Brasil. Dessa forma, aqueles que receberam tratamentos anteriores para tuberculose pulmonar evoluíram com uma maior frequência de astenia, e essa foi significativamente maior naqueles submetidos equivocadamente ao esquema RHZE por 3-4 vezes (p = 0,0491). Na Amazônia, as grandes distâncias e os poucos centros equipados para o acompanhamento dos pacientes com MNT constituem um fator de demora no diagnóstico e tratamento adequados desses pacientes.(16)
Apesar de não ter sido observada uma associação de bronquiectasias com os grupos estudados, essa comorbidade foi a mais prevalente neles, ratificando a grande associação entre infecção por MNT e bronquiectasias. Em um estudo retrospectivo observacional envolvendo doença pulmonar por CMA que incluiu 107 pacientes, os achados de bronquiectasias e cavitações correspondiam a 98% e 44% dos pacientes, respectivamente.(17) Com relação à classificação radiológica, a forma nodular-bronquiectásica naquele estudo foi associada a pacientes sem tratamento anterior para tuberculose pulmonar (p = 0,0325), o que pode ser devido ao fato de os médicos associarem cavitações à tuberculose pulmonar e, por isso, indicarem precocemente a pesquisa de BAAR no escarro, enquanto a presença de nódulos e/ou bronquiectasias requer uma investigação etiológica mais abrangente, necessitando de avaliação especializada.(18) Quanto ao tratamento das infecções pulmonares por micobactérias do CMA, a grande resistência aos fármacos do esquema RHZE encontra-se amplamente descrita. Destacam-se ainda mecanismos de resistência semelhantes aos contra macrolídeos e aminoglicosídeos, tornando esse grupo de pacientes de difícil resposta à terapêutica, piorando seu prognóstico.(19) Considerando os resultados da presente análise, a proporção de casos de CMA que não responderam ao primeiro esquema terapêutico e utilizaram um segundo ou um terceiro esquema foi quase 12 vezes maior nesses pacientes quando comparados aos do grupo MNT. Entre os fatores complicadores nessa fase do acompanhamento dos pacientes, destaca-se a ausência de testes de sensibilidade, os quais, por limitações técnicas e institucionais, não foram realizados, fazendo com que a maioria dos esquemas fosse iniciado com base nos poucos protocolos clínicos vigentes ou na experiência de especialistas que foram consultados, como orienta o próprio documento da ATS; portanto, com baixo nível de evidência.(20) Observa-se que, no grupo MNT, nenhum paciente necessitou utilizar o terceiro esquema com imipenem, o que pode ser justificado pelo perfil de sensibilidade diferenciado do MAC e de sua susceptibilidade aos esquemas com macrolídeos e fármacos antituberculose que se encontra estabelecido, inclusive no consenso da ATS.(20) Novas publicações, posteriores às da ATS, orientam o uso de terapia intermitente com medicações administradas apenas três vezes por semana na tentativa de aumentar a adesão dos pacientes,(10) devido ao tempo longo de tratamento somado aos possíveis efeitos colaterais dos fármacos; na amostra estudada, a chance de não adesão ao tratamento no grupo CMA foi 10 vezes maior que no grupo MNT. Na casuística em discussão, os pacientes do grupo MNT, composto em sua maior parte por portadores do MAC, obtiveram sucesso terapêutico após o uso do segundo esquema, ratificando os dados da literatura, que mostram um melhor prognóstico dos casos de doença pulmonar por MAC ou outras MNT do que daqueles por CMA.(21) Comparando as chances dos casos com M. massiliense - que na literatura parecem mostrar um perfil de sensibilidade quando tratados com esquema com macrolídeos - com aqueles com outras MNT, os primeiros apresentaram uma chance 10 vezes maior de necessidade de utilizar o segundo esquema terapêutico (IC95%: 1,4-74,5).(21)
Entre as micobactérias de crescimento lento, as de maior relevância são as do MAC que, segundo dados de publicações recentes, seus portadores apresentam melhor prognóstico e uma sobrevida de 13 anos. (20,21) A resposta terapêutica ao primeiro esquema (macrolídeo, etambutol e rifampicina) apresentou altos índices de cura em nossa casuística (83,2%) entre os pacientes do grupo MNT (composto em sua maioria por indivíduos com MAC), sendo que apenas 2 pacientes (9,0%) desse grupo necessitaram iniciar o segundo esquema, com diferença significativa entre os dois grupos. Os resultados encontrados no presente estudo, apesar das limitações técnicas pela ausência de testes de sensibilidade, além da limitação do desenho retrospectivo e de sua realização em um hospital de referência, o que pode ter gerado vieses de informação e seleção, são concordantes com a maioria dos estudos já publicados a respeito da evolução de pacientes com doença pulmonar causada por CMA.(22-24) Os desfechos desfavoráveis resultantes de tratamentos longos, utilizando diversas terapêuticas prescritas, somados aos efeitos adversos importantes, demonstram a urgente necessidade de uma rede laboratorial que identifique as espécies de MNT e que execute precocemente a análise de susceptibilidade, de forma a permitir que protocolos clínicos padronizados e específicos sejam avaliados e instituídos.
REFERÊNCIAS1. Nunes-Costa D, Talarico S, Dalcolmo M, Correia-Neves M, Empadinhas N. The looming tide of nontuberculous mycobacterial infection in Portugal and Brazil. Tuberculosis (Edinb). 2016;96:107-19. https://doi.org/10.1016/j.tube.2015.09.006
2. Nie W, Duan H, Huang H, Lu Y, Bi D, Chu N. Species identification of Mycobacterium abscessus subsp. abscessus and Mycobacterium abscessus subsp. bolletii using rpoB and hsp65, and susceptibility testing to eight antibiotics. Int J Infect Dis. 2014;25:170-4. https://doi.org/10.1016/j.ijid.2014.02.014
3. Rubio M, March F, Garrigó M, Moreno C, Español M, Coll P. Inducible and Acquired Clarithromycin Resistance in the Mycobacterium abscessus Complex. PloS One. 2015;10(10):e0140166. https://doi.org/10.1371/journal.pone.0140166
4. Lee MR, Sheng WH, Hung CC, Yu CJ, Lee LN, Hsueh PR. Mycobacterium abscessus Complex Infections in Humans. Emerg Infect Dis. 2015;21(9):1638-46. https://doi.org/10.3201/2109.141634
5. Cândido PH, Nunes Lde S, Marques EA, Folescu TW, Coelho FS, de Moura VC, et al. Multidrug-resistant nontuberculous mycobacteria isolated from cystic fibrosis patients. J Clin Microbiol. 2014;58(8):2990-7. https://doi.org/10.1128/JCM.00549-14
6. Williams MM, Yakrus MA, Arduino MJ, Cooksey RC, Crane CB, Banerjee S, et al. Structural analysis of biofilm formation by rapidly and slowly growing nontuberculous mycobacteria. Appl Environ Microbiol. 2009;75(7):2091-8. https://doi.org/10.1128/AEM.00166-09
7. de Mello KG, Mello FC, Borga L, Rolla V, Duarte RS, Sampaio EP, et al. Clinical and therapeutic features of pulmonary nontuberculous mycobacterial disease, Brazil, 1993-2011. Emerg Infect Dis. 2013;19(3):393-9.
8. Ayres M, Ayres Junior M, Ayres DL, Santos AS. Bioestat 5.0 - Aplicações estatísticas nas áreas das ciências biomédicas. Belém: ONG Mamiraua; 2007.
9. Sousa S, Bandeira M, Carvalho PA, Duarte A, Jordao L. Nontuberculous mycobacteria pathogenesis and biofilm assembly. Int J Mycobacteriol. 2015;4(1):36-43. https://doi.org/10.1016/j.ijmyco.2014.11.065
10. Mcshane PJ, Glassroth J. Pulmonary Disease Due To Nontuberculous Mycobacteria: Current State and New Insights. Chest. 2015;148(6):1517-1527. https://doi.org/10.1378/chest.15-0458
11. Adékambi T, Drancourt M. Mycobacterium bolletii respiratory infections. Emerg Infect Dis. 2009;15(2):302-5. https://doi.org/10.3201/eid1502.080837
12. Jeong BH, Kim SY, Jeon K, Huh HJ, Ki CS, Lee NY, et al. The First Korean Case of Nontuberculous Mycobacterial Lung Disease Caused by Mycobacterium abscessus Subspecies bolletii in a Patient with Bronchiectasis. Tuberc Respir Dis (Seoul). 2014;76(1):30-3. https://doi.org/10.4046/trd.2014.76.1.30
13. Prevots DR, Marras TK. Epidemiology of human pulmonary infection with nontuberculous mycobacteria: a review. Clin Chest Med. 2015;36(1):13-34. https://doi.org/10.1016/j.ccm.2014.10.002
14. Thomson R, Tolson C, Carter R, Coulter C, Huygens F, Hargreaves M. Isolation of nontuberculous mycobacteria (NTM) from household water and shower aerosols in patients with pulmonary disease caused by NTM. J Clin Microbiol. 2013;51(9):3006-11. https://doi.org/10.1128/JCM.00899-13
15. Harada T, Akiyama Y, Kurashima A, Nagai H, Tsuyuguchi K, Fujii T, et al. Clinical and microbiological differences between Mycobacterium abscessus and Mycobacterium massiliense lung diseases. J Clin Microbiol. 2012;50(11):3556-61. https://doi.org/10.1128/JCM.01175-12
16. Jarrand J, Levin A, Zhang L, Huitt G, Mitchell JD, Daley CL. Clinical and microbiologic outcomes in patients receiving treatment for Mycobacterium abscessus pulmonary disease. Clin Infect Dis. 2011;52(5):565-71. https://doi.org/10.1093/cid/ciq237
17. Chung MJ, Lee KS, Koh WJ, Lee JH, Kim TS, Kwon OJ, et al. Thin-section CT findings of nontuberculous mycobacterial pulmonary diseases: comparison between Mycobacterium avium-intracellulare complex and Mycobacterium abscessus infection. J Korean Med Sci. 2005;20(5):777-83. https://doi.org/10.3346/jkms.2005.20.5.777
18. Chu H, Li B, Zhao L, Huang D, Xu J, Zhang J, et al. Tree-in-bud pattern of chest CT images for diagnosis of Mycobacterium abscessus. Int J Clin Exp Med. 2015; 8(10):18705-12. eCollection 2015.
19. Philley JV, Griffith DE. Treatment of slowly growing mycobacteria. Clin Chest Med. 2015;36(1):79-90. https://doi.org/10.1016/j.ccm.2014.10.005
20. Maurer FP, Castelberg C, Quiblier C, Böttger EC, Somoskövi A. Erm(41)-dependent inducible resistance to azithromycin and clarithromycin in clinical isolates of Mycobacterium abscessus. J Antimicrob Chemother. 2014;69(6):1559-63. https://doi.org/10.1093/jac/dku007
21. Shin SJ, Choi GE, Cho SN, Woo SY, Jeong BH, Jeon K, et al. Mycobacterial genotypes are associated with clinical manifestation and progression of lung disease caused by Mycobacterium abscessus and Mycobacterium massiliense. Clin Infect Dis. 2013;57(1):32-9. https://doi.org/10.1093/cid/cit172
22. Olivier KN, Shaw PA, Glaser TS, Bhattacharyya D, Fleshner M, Brewer CC, et al. Inhaled amikacin for treatment of refractory pulmonary nontuberculous mycobacterial disease. Ann Am Thorac Soc. 2014;11(1):30-5. https://doi.org/10.1513/AnnalsATS.201307-231OC
23. Plotinsky RN, Talbot E, von Reyn CF. Proposed definitions for epidemiologic and clinical studies of Mycobacterium avium complex pulmonary disease. PloS One. 2013;8(11):e77385. https://doi.org/10.1371/journal.pone.0077385
Kotilainen H, Valtonen V, Tukiainen P, Poussa T, Eskola J, Järvinen A. Clinical findings in relation to mortality in non-tuberculous mycobacterial infections: patients with Mycobacterium avium complex have better survival than patients with other mycobacteria. Eur J Clin Microbiol Infect Dis. 2015;34(9):1909-18. https://doi.org/10.1007/s10096-015-2432-8






