ABSTRACT
Objective: Clinical trials have shown that nintedanib 150 mg twice daily (bid) reduces disease progression in patients with idiopathic pulmonary fibrosis (IPF), with an adverse event profile that is manageable for most patients. Prior to the approval of nintedanib as a treatment for IPF in Brazil, an expanded access program (EAP) was initiated to provide early access to treatment and to evaluate the safety and tolerability of nintedanib in this patient population. Methods: Patients with a diagnosis of IPF within the previous five years, forced vital capacity (FVC) ≥ 50% predicted and diffusing capacity of the lungs for carbon monoxide (DLco) 30% to 79% predicted were eligible to participate in the EAP. Patients received nintedanib 150 mg bid open-label. Safety assessments included adverse events leading to permanent discontinuation of nintedanib and serious adverse events. Results: The EAP involved 57 patients at eight centers. Most patients were male (77.2%) and white (87.7%). At baseline, mean (SD) age was 70.7 (7.5) years and FVC was 70.7 (12.5) % predicted. Mean (SD) exposure to nintedanib was 14.4 (6.2) months; maximum exposure was 22.0 months. The most frequently reported adverse events considered by the investigator to be related to nintedanib treatment were diarrhea (45 patients, 78.9%) and nausea (25 patients, 43.9%). Adverse events led to permanent discontinuation of nintedanib in 16 patients (28.1%). Sixteen patients (28.1%) had a serious adverse event. Conclusion: In the Brazilian EAP, nintedanib had an acceptable safety and tolerability profile in patients with IPF, consistent with data from clinical trials.
Keywords:
Drug tolerance; Expanded access program; Interstitial lung disease; Tyrosine kinase inhibitor.
RESUMO
Objetivo: Ensaios clínicos mostraram que 150 mg de Nintedanibe duas vezes ao dia reduzem a progressão da doença em pacientes com Fibrose Pulmonar Idiopática (FPI), com um perfil de efeitos adversos que é controlável para a maioria dos pacientes. Antes da aprovação do Ninte-danibe como tratamento para a FPI no Brasil, um Programa de Acesso Expandido (PEA) foi inicia-do para fornecer acesso precoce ao tratamento e avaliar a segurança e a tolerância do Ninteda-nibe para este grupo de pacientes. Métodos: Foram elegíveis para participar da PEA pacientes com diagnóstico de FPI nos últimos 5 anos, com capacidade vital forçada (CVF) ≥ 50% do previsto e capacidade de difusão dos pulmões para monóxido de carbono (DLco) 30%-79% do previsto. Os pacientes receberam Nintedanibe 150 mg, 2 vezes ao dia (bid). As avaliações de segurança incluí-ram eventos adversos que levaram à suspensão permanente do Nintedanibe e eventos adver-sos graves. Resultados: O PEA envolveu 57 pacientes em 8 centros. A maioria dos pacientes era do sexo masculino (77,2%) e brancos (87,7%). No início do estudo, a média de idade foi de 70,7 (7,5) anos e a CVF foi de 70,7 (12,5%) do previsto. A média de exposição ao Nintedanibe foi de 14,4 (6,2) meses; a exposição máxima foi de 22,0 meses. Os eventos adversos frequentemente relatados pelo pesquisador como relacionados ao tratamento com Nintedanibe foram diarreia (45 pacientes, 78,9%) e náusea (25 pacientes, 43,9%). Os eventos adversos levaram à suspensão permanente do Nintedanibe em 16 pacientes (28,1%) que passaram por um evento adverso grave. Conclusões: No PEA brasileiro, o Nintedanibe apresentou um perfil aceitável de segurança e tolerância em pacientes com FPI, condizendo com dados de ensaios clínicos.
Palavras-chave:
Fibrose pulmonar idiopática; Programa de acesso expandido; Doença pulmonar intersticial; Inibidor de tirosina quinase.
INTRODUÇÃOA Fibrose Pulmonar Idiopática (FPI) é uma doença pulmonar intersticial fibrosante progressiva caracterizada pelo declínio da função pulmonar, piora da dispneia e da qualidade de vida.(1) A FPI geralmente se apresenta na 6ª ou 7ª década de vida de ex-fumantes, é mais comum em homens do que em mulheres(1) e possui uma evolução clínica variável mas um prognóstico ruim. Dados norte americanos demonstram que antes da disponibilidade de terapias aprovadas para FPI a média da sobrevida pós-diagnóstico em pacientes com FPI era de 3 a 5 anos.(2,3) Análises do Sistema de Informações sobre Mortalidade (SIM) do Ministério da Saúde brasileiro sugerem que, no Brasil, a mortalidade devida à FPI aumentou de 0,24 a cada 100 mil casos em 1979 para 1,10 por 100 mil casos em 2014.(4) Este aumento foi provavelmente devido à melhoria do diagnóstico e notificação de FPI, bem como ao envelhecimento da população. A FPI provavelmente permanece significativamente subdiagnosticada no Brasil devido à baixa conscientização da doença, aos desafios que a realização do diagnóstico apresenta e ao pequeno número de centros especializados.
O Nintedanibe é um inibidor intracelular das tirosinas quinase envolvidas na patogênese da FPI, incluindo o receptor do fator de crescimento derivado de plaquetas, o receptor do fator de crescimento de fibroblastos e o receptor do fator de crescimento endotelial vascular.(5) A eficácia e a segurança do tratamento de 52 semanas com 150 mg de Nintedanibe, 2 vezes ao dia (bid) em pacientes com FPI foram avaliadas no teste Fase II TOMORROW(6) e nos dois testes Fase III INPULSIS.(7) Estes estudos demonstraram que o Nintedanibe reduziu a progressão da doença e a taxa de declínio na Capacidade Vital Forçada (CVF). Uma análise dos dados agrupados dos estudos INPULSIS, por sua vez, sugeriu que o Nintedanibe também reduziu o risco de exacerbações agudas.(8) No entanto, o perfil de segurança e tolerância do Nintedanibe foi caracterizado predominantemente por eventos adversos gastrointestinais, particularmente a diarreia.(9,10)
O Nintedanibe foi aprovado para o tratamento da FPI em muitos países, incluindo o Brasil e vários outros países da América Latina, bem como os EUA, a Europa e vários países da Ásia. Nas últimas diretrizes internacionais de tratamento para FPI, o Nintedanibe recebeu uma recomendação condicional para uso, indicando que seria uma escolha apropriada para a maioria dos pacientes, embora reconhecendo que escolhas diferentes serão apropriadas para cada paciente, dependendo dos valores e preferências individuais.(11)
Antes da aprovação do Nintedanibe no Brasil, em fevereiro de 2016, um Programa de Acesso Expandido (PAE) foi iniciado para fornecer acesso precoce ao tratamento e mais informações sobre a segurança e a tolerância do Nintedanibe em pacientes com FPI. Assim, este trabalho visa relatar dados sobre a segurança e tolerância do Nintedanibe que foram coletados neste PAE.
MÉTODOSPlanejamentoUm PAE que oferecia tratamento aberto com Nintedanibe foi iniciado em oito centros médicos no Brasil em fevereiro de 2015. Como critério de participação, os pacientes deveriam ter ≥ 40 anos de idade, diagnóstico de FPI de acordo com as diretrizes ATS/ERS/JRS/ALAT de 2011(1) nos últimos 5 anos, capacidade de difusão dos pulmões para o monóxido de carbono (DLco) de 30%-79% do previsto e CVF ≥ 50% do previsto. Os critérios de exclusão incluíram níveis de alanina aminotransferase (ALT), aspartato aminotransferase (AST) ou bilirrubina > 1,5 vez o limite superior da normalidade (LSN); infarto do miocárdio nos 6 meses de triagem; angina instável no mês 1 de triagem; risco de sangramento (por exemplo, necessidade de fibrinólise, anticoagulação de dose plena ou terapia antiplaquetária de dose elevada); suspensão permanente do Nintedanibe devido a eventos adversos relacionados ao medicamento em um ensaio clínico; e tratamento atual ou planejado com pirfenidona, azatioprina, ciclofosfamida, ciclosporina ou prednisona em dose > 15 mg/dia, ou > 30 mg a cada 2 dias ou dose equivalente de outros corticosteroides orais.
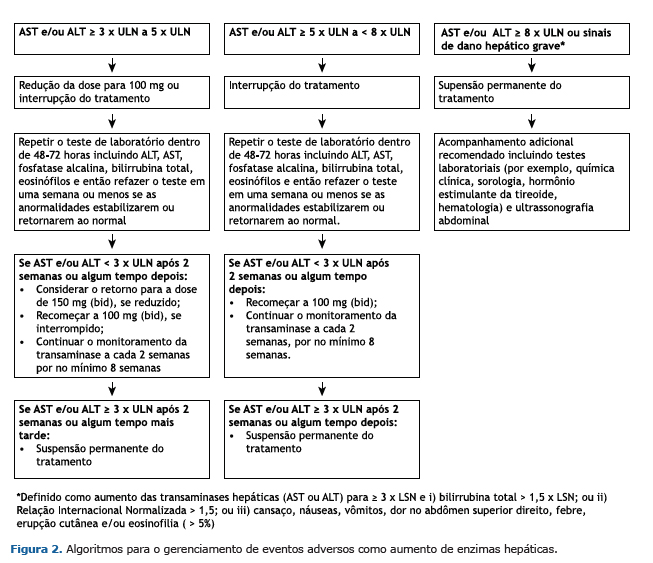
Após um período de quatro semanas de análise, os pacientes receberam 150 mg de Nintedanibe (bid) durante o PAE, até o medicamento tornar-se comercialmente disponível ou até a suspensão permanente do tratamento. Uma visita de acompanhamento ocorreu 28 dias após a interrupção do tratamento, interrupções por até 12 semanas e reduções de dose para 100 mg (bid) foram permitidas para gerenciar eventos adversos. Quando a dose era reduzida, só poderia ser aumentada novamente para 150 mg (bid) após a resolução do evento adverso. Além disso, os pesquisadores receberam recomendações sobre o manejo da diarreia e elevação das enzimas hepáticas (Figuras 1 e 2) e solicitou-se que relatassem quaisquer tipos de tratamentos usados concomitantemente para tratar a FPI ou controlar a diarreia em um formulário de relato de caso. Tais tratamentos concomitantes foram definidos como tratamentos que foram recebidas no início ou foram iniciados entre a primeira e a última ingestão de Nintedanibe. Estes tratamentos concomitantes foram codificados de acordo com o WHO Drug Dictionary(12) (versão 17 de março).

Como este era um PAE, a aprovação do protocolo do Comitê de Ética não era obrigatória. No entanto, os Comitês de Ética Independentes dos centros participantes receberam o folheto informativo, o formulário de consentimento prévio e outros documentos para autorização.
O programa foi conduzido de acordo com os princípios da Declaração de Helsinque, de acordo com a diretriz da Conferência Internacional de Harmonização para a Boa Prática Clínica e de acordo com os requisitos regulamentares aplicáveis e procedimentos operacionais padrão. Todos os pacientes forneceram consentimento prévio por escrito antes de entrar no programa. O programa foi registrado em www.clinicaltrials.gov (NCT02230982).
O primeiro paciente foi inscrito em 23 de março de 2015 e o último foi examinado em 3 de novembro de 2015, enquanto o medicamento Nintedanibe tornou-se comercialmente disponível para o tratamento de FPI no Brasil apenas em 16 de fevereiro de 2016. Entre janeiro de 2017 e março de 2017, todos os pacientes que tomaram Nintedanibe no PEA passaram pela transição de uso para Nintedanibe comercial no mesmo local e com o mesmo pesquisador.
DesfechosO critério segurança foi avaliado em pacientes que receberam ≥ 1 dose de Nintedanibe e consistiu no registro de eventos adversos que atendiam aos seguintes critérios: eventos adversos graves; acontecimentos adversos de interesse especial (isto é, acontecimentos adversos da lesão hepática [definida como AST ou ALT ≥ 3 × ULN e bilirrubina total ≥ 2 × ULN] ou relacionado à perfuração gastrointestinal); acontecimentos adversos que conduzem a interrupção ou redução da dose de Nintedanibe; acontecimentos adversos relacionados à administração de Nintedanibe que não foram considerados graves pelo pesquisador; agravamento da doença subjacente ou outras condições preexistentes; alterações nos resultados de quaisquer procedimentos, isto é, sinais vitais, exame físico, exames laboratoriais, julgados clinicamente relevantes pelo pesquisador. Eventos adversos sérios foram definidos como fatais ou com risco de morte, hospitalização necessária ou prolongada, associados a uma anomalia congênita ou que resultaram em algum tipo de deficiência.
Os eventos adversos foram registrados em visitas realizadas na análise nas semanas 4, 8, 12, 24; a cada 12 semanas, até o final do tratamento; e na visita de acompanhamento após 28 dias. No entanto, poderiam ser registrados em qualquer outro momento da análise, se o pesquisador tivesse conhecimento deles. Vale ressaltar que estes eventos foram codificados de acordo com os termos preferidos no Dicionário Médico para Atividades Regulamentares (MedDRA) versão 20.0 e categorizados pelo pesquisador da seguinte forma: leves (consciência de sinais ou sintomas que foram facilmente tolerados), moderados (desconforto suficiente para causar interferência na atividade habitual) ou graves (incapacidade total ou incapacidade de trabalhar ou realizar atividades habituais). Os dados de segurança são apresentados de forma descritiva.
RESULTADOSPacientesUm total de 57 pacientes foram tratados com Nintedanibe. A maioria deles era do sexo masculino (77,2%), cor branca (87,7%) e atual ou ex-fumantes (64,9%); 22,8% dos pacientes foram submetidos à biópsia pulmonar cirúrgica (Tabela 1). No início do estudo, a idade média (DP) foi de 70,7 (7,5) anos, a CVF foi de 70,7 (12,5)% do previsto e a DLco foi de 48,7 (13,4%) do previsto. As condições de comorbidade mais frequentes no início do estudo foram hipertensão (47,4%), dislipidemia (21,1%), doença do refluxo gastroesofágico (21,1%) e diabetes mellitus (17,5%) (Tabela 1).
 Tratamentos concomitantes
Tratamentos concomitantesOs tratamentos concomitantes estão descritos na Tabela 2.
Os tratamentos antidiarreicos foram os mais comumente usados, recebidos por 36 pacientes (63,2%). Já outros 6 pacientes (10,5%) receberam N-acetilcisteína e 13 pacientes (22,8%) receberam corticosteroides sistêmicos.
 Exposição
ExposiçãoA exposição média ao Nintedanibe foi de 14,4 (6,2) meses e a exposição máxima foi de 22,0 meses. No total, 24 pacientes (42,1%) tiveram ≥ 1 interrupção do tratamento e 21 pacientes (36,8%) tiveram ≥ 1 redução da dose para 100 mg (bid). A maioria dos doentes (70,2%) recebeu 150 mg de Nintedanibe (bid) como a última dose. Trinta e sete pacientes (64,9%) ainda estavam recebendo Nintedanibe no final do programa, enquanto 20 pacientes (35,1%) haviam descontinuado permanentemente o tratamento com o medicamento. A razão mais frequente para a suspensão permanente do Nintedanibe foram eventos adversos (16 de 20 doentes).
Segurança e tolerânciaQuase todos os pacientes (n = 55; 96,5%) sofreram ao menos ≥ 1 evento adverso que preencheu os critérios de notificação (Tabela 3). A diarreia, relatada em 45 pacientes (78,9%) foi classificada como o evento mais comum. Entre os pacientes diagnosticados com diarreia, a intensidade foi leve em 22 pacientes (48,9%), moderada em 13 pacientes (28,9%) e grave em 10 pacientes (22,2%). Já náuseas e vômitos foram relatados em 25 (43,9%) e 9 (15,8%) pacientes, respectivamente, e quase todos eles eram de intensidade leve ou moderada (Tabela 4). A maioria dos pacientes com diarreia (66,7%), náusea (80%) e vômitos (66,7%) continuou o tratamento com Nintedanibe sem redução da dose ou interrupção.

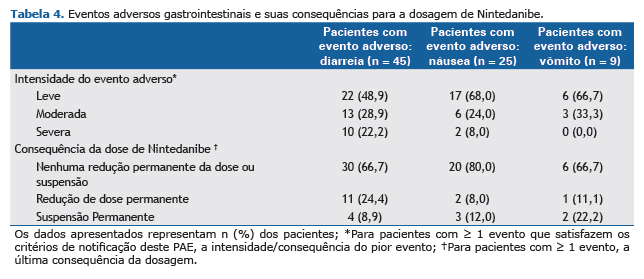
O aumento das enzimas hepáticas foi observado em apenas um paciente em que a lesão hepática ocasionada pelo medicamento foi classificada como evento adverso grave. Não foram relatados casos de ALT e/ou AST ≥ 3 × ULN e bilirrubina total ≥ 2 × LSN ou eventos adversos relacionados à perfuração gastrointestinal.
Todavia, os eventos adversos levaram à suspensão permanente de Nintedanibe em 16 pacientes (28,1%), o mais frequente deles foi a diarreia (em 4 pacientes (7,0%) (Tabela 3). Nenhum tipo de evento adverso grave (com base nos termos preferidos pelo MedDRA) foi relatado em > 1 paciente, exceto para progressão de FPI (3 pacientes), pneumonia (2 pacientes) e infecção do trato urinário (2 pacientes); 3 pacientes (5,3%) tiveram eventos adversos que levaram à morte: pneumonia (1 paciente), pneumonia e progressão da FPI (1 paciente) e dispneia (1 paciente). Nenhum dos eventos adversos fatais ocorreu relacionado ao uso de Nintedanibe, segundo o pesquisador.
DISCUSSÃONesta versão brasileira do PAE para Nintedanibe em pacientes com FPI, o uso de 150 mg (bid) do medicamento apresentou perfil aceitável de segurança e de tolerância e dados de análises clínicas condizentes (6,7,10). Eventos adversos gastrintestinais, particularmente diarreia, foi o efeito adverso mais frequentemente relatado. Diarreia é um evento adverso comumente associado com os inibidores de tirosina quinase, no entanto o mecanismo pelo qual ele ocorre permanece incerto.(13) Para a maioria dos pacientes que tiveram diarreia na PAE brasileiro ela foi de intensidade leve ou moderada e a maioria deles continuou com o uso de Nintedanibe sem redução da dose ou interrupção do tratamento; entretanto, quase dois terços dos pacientes receberam tratamento antidiarreico. Recomenda-se que os pacientes que apresentem diarreia durante o tratamento com Nintedanibe devam manter uma hidratação adequada e realizar tratamento antidiarreico (por exemplo, Loperamida) assim que os sintomas surgirem.(14,15)
Deve-se ressaltar que o tratamento com Nintedanibe pode elevar os níveis das enzimas hepáticas e que casos de lesão hepática induzida por medicação foram observados neste estudo.(14,15) A lesão hepática induzida no PAE brasileiro foi classificada como evento adverso grave em um paciente. No entanto, não foram relatados casos de ALT e/ou AST ≥ 3 × ULN e bilirrubina total ≥ 2 x LSN. Recomenda-se a realização de testes de função hepática antes do início do tratamento com Nintedanibe, com intervalos regulares durante os primeiros três meses de tratamento e, posteriormente, periodicamente.(14,15) Reduções de dose ou interrupções de tratamento para controlar elevações nas enzimas hepáticas poderão ser necessárias.
Além deste PAE no Brasil, dados sobre a segurança e tolerância do Nintedanibe foram coletados a partir de vários outros programas de uso compassivo (ou por acesso antecipado) e de vigilância pós-comercialização. Em consonância com achados deste trabalho, os dados desses estudos sugerem que o Nintedanibe apresenta um perfil semelhante de segurança e tolerância na prática clínica, como observado em ensaios clínicos.(16-23) Dados de vigilância pós-comercialização mostraram que em 6.758 pacientes tratados com Nintedanibe nos EUA, no ano seguinte ao seu lançamento como tratamento para FPI, diarreia, náusea e vômito foram os eventos adversos mais frequentemente relatados.(18) Em um estudo observacional de 94 pacientes com FPI na Grécia, a diarreia foi relatada em 55% dos pacientes tratados com Nintedanibe durante um período de acompanhamento de 12 meses, e 12% dos pacientes interromperam o uso de Nintedanibe devido à este efeito.(20)
No PEA brasileira, 11% e 23% dos pacientes tratados com Nintedanibe receberam tratamento concomitante com N-acetilcisteína e corticosteroides sistêmicos, respectivamente. Em uma pesquisa recente com 455 médicos da América Latina, 29% e 48% prescreveram N-acetilcisteína e corticosteroides, respectivamente, para o tratamento da FPI.(24) Esses achados sugerem que o uso dessas terapias de baixo custo permanece elevado na América Latina, apesar da falta de evidências que comprovem sua eficácia como tratamento para FPI.(11,25,26)
Em conclusão, em um PEA para pacientes com FPI no Brasil, o uso de 150 mg de Nintedanibe, 2 vezes ao dia, apresentou um perfil aceitável de segurança e tolerabilidade, consistente com o observado em ensaios clínicos.
AGRADECIMENTOSO Programa de Acesso Expandido ao Nintedanibe foi financiado pela Boehringer Ingelheim. A assistência médica escrita recebeu apoio financeiro de Boehringer Ingelheim, fornecido por Tove Anderson e Julie Fleming da Fleishman Hillard Fishburn durante a elaboração deste artigo.
Os autores foram totalmente responsáveis por todos os conteúdos e decisões editoriais, estavam envolvidos em todas as etapas do desenvolvimento do manuscrito e aprovaram a versão final, que reflete suas interpretações e as conclusões.
REFERÊNCIAS1. Raghu G, Collard HR, Egan JJ, Martinez FJ, Behr J, Brown KK, et al. An official ATS/ERS/JRS/ALAT statement: idiopathic pulmonary fibrosis: evidence-based guidelines for diagnosis and management. Am J Respir Crit Care Med. 2011;183(6):788-824. http://dx.doi.org/10.1164/rccm.2009-040GL. PMid:21471066.
2. Fernández Pérez ER, Daniels CE, St. Sauver J, Hartman TE, Bartholmai BJ, Yi ES, et al. Incidence, prevalence, and clinical course of idiopathic pulmonary fibrosis: a population-based study. Chest. 2010;137(1):129-37. http://dx.doi.org/10.1378/chest.09-1002. PMid:19749005.
3. Raghu G, Chen SY, Yeh WS, Maroni B, Li Q, Lee YC, et al. Idiopathic pulmonary fibrosis in US Medicare beneficiaries aged 65 years and older: incidence, prevalence, and survival, 2001-11. Lancet Respir Med. 2014;2(7):566-72. http://dx.doi.org/10.1016/S2213-2600(14)70101-8. PMid:24875841.
4. Algranti E, Saito CA, Silva DRME, Carneiro APS, Bussacos MA. Mortality from idiopathic pulmonary fibrosis: a temporal trend analysis in Brazil, 1979-2014. J Bras Pneumol. 2017;43(6):445-50. http://dx.doi.org/10.1590/s1806-37562017000000035. PMid:29340493.
5. Wollin L, Wex E, Pautsch A, Schnapp G, Hostettler KE, Stowasser S, et al. Mode of action of Nintedanibe in the treatment of idiopathic pulmonary fibrosis. Eur Respir J. 2015;45(5):1434-45. http://dx.doi.org/10.1183/09031936.00174914. PMid:25745043.
6. Richeldi L, Costabel U, Selman M, Kim DS, Hansell DM, Nicholson AG, et al. Efficacy of a tyrosine kinase inhibitor in idiopathic pulmonary fibrosis. N Engl J Med. 2011;365(12):1079-87. http://dx.doi.org/10.1056/NEJMoa1103690. PMid:21992121.
7. Richeldi L, du Bois RM, Raghu G, Azuma A, Brown KK, Costabel U, et al. Efficacy and safety of Nintedanibe in idiopathic pulmonary fibrosis. N Engl J Med. 2014;370(22):2071-82. http://dx.doi.org/10.1056/NEJMoa1402584. PMid:24836310.
8. Collard HR, Richeldi L, Kim DS, Taniguchi H, Tschoepe I, Luisetti M, et al. Acute exacerbations in the INPULSIS trials of Nintedanibe in idiopathic pulmonary fibrosis. Eur Respir J. 2017;49(5):1601339. http://dx.doi.org/10.1183/13993003.01339-2016. PMid:28526798.
9. Corte T, Bonella F, Crestani B, Demedts MG, Richeldi L, Coeck C, et al. Safety, tolerability and appropriate use of Nintedanibe in idiopathic pulmonary fibrosis. Respir Res. 2015;16(1):116. http://dx.doi.org/10.1186/s12931-015-0276-5. PMid:26400368.
10. Richeldi L, Cottin V, du Bois RM, Selman M, Kimura T, Bailes Z, et al. Nintedanibe in patients with idiopathic pulmonary fibrosis: combined evidence from the TOMORROW and INPULSIS trials. Respir Med. 2016;113:74-9. http://dx.doi.org/10.1016/j.rmed.2016.02.001. PMid:26915984.
11. Raghu G, Rochwerg B, Zhang Y, Garcia CA, Azuma A, Behr J, et al. An official ATS/ERS/JRS/ALAT clinical practice guideline: treatment of idiopathic pulmonary fibrosis. an update of the 2011 clinical practice guideline. Am J Respir Crit Care Med. 2015;192(2):e3-19. http://dx.doi.org/10.1164/rccm.201506-1063ST. PMid:26177183.
12. WHO: World Health Organization. [cited 2018 June 29]. Available from: http://umd.emro.who.int/WHODictionary
13. Bowen JM. Mechanisms of TKI-induced diarrhea in cancer patients. Curr Opin Support Palliat Care. 2013;7(2):162-7. http://dx.doi.org/10.1097/SPC.0b013e32835ec861. PMid:23399616.
14. Boehringer Ingelheim Pharmaceuticals, Inc. OFEV (Nintedanibe) US prescribing information [Internet]. 2018 [cited 2018 June 29]. Available from: https://www.ofev.com/
15. Boehringer Ingelheim. OFEV (Nintedanibe) EU Summary of Product Characteristics [Internet]. 2018 [cited 2018 June 29]. Available from: http://www.ema.europa.eu/ema/
16. Bonella F, Kreuter M, Hagmeyer L, Neurohr C, Keller C, Kohlhaeufl MJ, et al. Insights from the German compassionate use program of Nintedanibe for the treatment of idiopathic pulmonary fibrosis. Respiration. 2016;92(2):98-106. http://dx.doi.org/10.1159/000448288. PMid:27544537.
17. Galli JA, Pandya A, Vega-Olivo M, Dass C, Zhao H, Criner GJ. Pirfenidone and nitedanib for pulmonary fibrosis in clinical practice: tolerability and adverse drug reactions. Respirology. 2017;22(6):1171-8 . http://dx.doi.org/10.1111/resp.13024. PMid:28317233.
18. Noth I, Oelberg D, Kaul M, Conoscenti CS, Raghu G. Safety and tolerability of nintedanib in patients with idiopathic pulmonary fibrosis in the USA. Eur Respir J. 2018;52(1):1702106. http://dx.doi.org/10.1183/13993003.02106-2017. PMid:29794129.
19. Brunnemer E, Wälscher J, Tenenbaum S, Hausmanns J, Schulze K, Seiter M, et al. Real-world experience with Nintedanibe in patients with idiopathic pulmonary fibrosis. Respiration. 2018;95(5):301-9 . http://dx.doi.org/10.1159/000485933. PMid:29490307.
20. Tzouvelekis A, Karampitsakos T, Kontou M, Granitsas A, Malliou I, Anagnostopoulos A, et al. Safety and efficacy of Nintedanibe in idiopathic pulmonary fibrosis: a real-life observational study. Pulm Pharmacol Ther. 2018;49:61-6. http://dx.doi.org/10.1016/j.pupt.2018.01.006. PMid:29366978.
21. Bargagli E, Piccioli C, Rosi E, Torricelli E, Turi L, Piccioli E, et al. Pirfenidone and Nintedanibe in idiopathic pulmonary fibrosis: real-life experience in an Italian referral centre. Pulmonology. 2019;25(3): 149-53. http://dx.doi.org/10.1016/j.pulmoe.2018.06.003.
22. Yoon HY, Park S, Kim DS, Song JW. Efficacy and safety of Nintedanibe in advanced idiopathic pulmonary fibrosis. Respir Res. 2018;19(1):203. http://dx.doi.org/10.1186/s12931-018-0907-8. PMid:30340638.
23. Fletcher SV, Jones MG, Renzoni EA, Parfrey H, Hoyles RK, Spinks K, et al. Safety and tolerability of Nintedanibe for the treatment of idiopathic pulmonary fibrosis in routine UK clinical practice. ERJ Open Res. 2018;4(4):00049-02018. http://dx.doi.org/10.1183/23120541.00049-2018. PMid:30364342.
24. Cherrez-Ojeda I, Cottin V, Calderón JC, Delgado C, Calero E, Simanca-Racines D, et al. Management and attitudes about IPF (idiopathic pulmonary fibrosis) among physicians from Latin America. BMC Pulm Med. 2018;18(1):5. http://dx.doi.org/10.1186/s12890-017-0569-1. PMid:29321018.
25. Martinez FJ, Andrade JA, Anstrom KJ, King TE Jr, Raghu G. Randomized trial of acetylcysteine in idiopathic pulmonary fibrosis. N Engl J Med. 2014;370(22):2093-101. http://dx.doi.org/10.1056/NEJMoa1401739. PMid:24836309.
26. Richeldi L, Davies HR, Ferrara G, Franco F. Corticosteroids for idiopathic pulmonary fibrosis. Cochrane Database Syst Rev. 2003;(3):CD002880. PMid:12917934.







