ABSTRACT
Objective: To evaluate small airway disease in COVID-19 patients using the prevalence of air trapping (AT) and correlating it with clinical outcomes. The relationship between CT-based opacities in small blood vessels and ventilation in patients with SARS-CoV-2 pneumonia was also assessed. Methods: We retrospectively included 53 patients with positive RT-PCR results for SARS-CoV-2 between March and April of 2020. All subjects underwent HRCT scanning, including inspiratory and expiratory acquisitions. Subjects were divided into two groups based on visual identification of AT. Small blood vessel volumes were estimated by means of cross-sectional areas < 5 mm2 (BV5) derived from automated segmentation algorithms. Mixed-effect models were obtained to represent the BV5 as a function of CT-based lobar opacities and lobar ventilation. Results: Of the 53 participants, AT was identified in 23 (43.4%). The presence of AT was associated with increased SpO2 at admission (OR = 1.25; 95% CI, 1.07-1.45; p = 0.004) and reduced D-dimer levels (OR = 0.99; 95% CI, 0.99-0.99; p = 0.039). Patients with AT were less likely to be hospitalized (OR = 0.27; 95% CI, 0.08-0.89; p = 0.032). There was a significant but weak inverse correlation between BV5 and CT-based lobar opacities (R2 = 0.19; p = 0.03), as well as a nonsignificant and weak direct correlation between BV5 and lobar ventilation (R2 = 0.08; p = 0.54). Conclusions: AT is a common finding in patients with COVID-19 that undergo expiratory CT scanning. The presence of AT may correlate with higher SpO2 at admission, lower D-dimer levels, and fewer hospitalizations when compared with absence of AT. Also, the volume of small pulmonary vessels may negatively correlate with CT opacities but not with lobar ventilation.
Keywords:
SARS-CoV-2; COVID-19; Tomography, X-ray.
RESUMO
Objetivo: Avaliar a doença das pequenas vias aéreas em pacientes com COVID-19 por meio da prevalência de aprisionamento aéreo (AA) e sua correlação com desfechos clínicos. Também foi avaliada a relação entre opacidades tomográficas nos pequenos vasos sanguíneos e ventilação em pacientes com pneumonia por SARS-CoV-2. Métodos: Foram incluídos, retrospectivamente, 53 pacientes com teste de RT-PCR positivo para SARS-CoV-2 entre março e abril de 2020. Todos os indivíduos foram submetidos à TCAR, incluindo aquisições inspiratórias e expiratórias. Os indivíduos foram divididos em dois grupos com base na identificação visual de AA. Os volumes dos pequenos vasos sanguíneos foram estimados por meio de seções transversais < 5 mm2 (VS5) derivadas de algoritmos automatizados de segmentação. Modelos de efeito misto foram obtidos para representar o VS5 em função das opacidades lobares tomográficas e da ventilação lobar. Resultados: Identificou-se AA em 23 (43,4%) dos 53 participantes. A presença de AA apresentou associação com SpO2 elevada na admissão (OR = 1,25; IC95%: 1,07-1,45; p = 0,004) e níveis reduzidos de dímero D (OR = 0,99; IC95%: 0,99-0,99; p = 0,039). Pacientes com AA apresentaram menor probabilidade de hospitalização (OR = 0,27; IC95%: 0,08-0,89; p = 0,032). Houve correlação inversa significativa, mas fraca, entre VS5 e opacidades lobares tomográficas (R2 = 0,19; p = 0,03) e correlação direta não significativa e fraca entre VS5 e ventilação lobar (R2 = 0,08; p = 0,54). Conclusões: AA é um achado comum em pacientes com COVID-19 submetidos à TC expiratória. A presença de AA pode apresentar correlação com SpO2 elevada na admissão, níveis reduzidos de dímero D e menor probabilidade de hospitalização. Além disso, o volume dos pequenos vasos pulmonares pode apresentar correlação negativa com opacidades tomográficas, mas não com ventilação lobar.
Palavras-chave:
SARS-CoV-2; COVID-19; Tomografia computadorizada por raios X.
INTRODUÇÃO O curso da pneumonia por SARS-CoV-2 é caracterizado por hipoxemia grave com complacência pulmonar preservada.(1,2) As causas subjacentes da insuficiência respiratória aguda por COVID-19 são lesão vascular e vasoconstrição, com lesão microvascular causando vazamento de exsudato pulmonar, que é característico da pneumonia por SARS-CoV-2.(1,2) A presença de exsudatos inflamatórios nas vias aéreas levando ao remodelamento das vias aéreas e à destruição das paredes alveolares foi descrita como a fisiopatologia de outras doenças pulmonares, como a DPOC e a asma. Esse dano às pequenas vias aéreas leva a obstrução do fluxo aéreo e aprisionamento aéreo (AA), que são marcadores de gravidade e prognóstico da COVID-19. (3,4) O AA também foi relatado na hipertensão pulmonar causada pelo aumento do calibre das artérias em áreas de atenuação elevada (hiperemia) em comparação com vasos menores em áreas de baixa atenuação (oligemia).(5) Um grupo de autores relatou que a presença de AA foi significativamente mais comum em pacientes com COVID-19 admitidos na UTI ou que morreram.(6) Assim, é razoável questionar se a COVID-19 poderia resultar em danos às pequenas vias aéreas e AA e se a trombose microvascular pode contribuir para constrição bronquiolar ou doença das pequenas vias aéreas.(7)
A TC de tórax tem desempenhado um papel significativo na avaliação da COVID-19, e achados anormais na TC foram relatados em até 90% dos pacientes hospitalizados. (8,9) A predominância de opacidades em vidro fosco (OVF) é um dos padrões mais comuns da pneumonia por SARS-CoV-2.(8,9) Embora os exames de imagem não possam diagnosticar SARS-CoV-2, eles podem avaliar a gravidade e a extensão do envolvimento do trato respiratório inferior, bem como fornecer diagnósticos alternativos e revelar patologias concomitantes, como a embolia pulmonar.(10,11) No entanto, o papel das aquisições de TC expiratórias na COVID-19 ainda não está claro, e a maioria dos centros de imagem inclui apenas as fases inspiratórias para evitar a exposição do paciente a doses adicionais de radiação. (12) Assim, a prevalência de AA em pacientes com COVID-19 pode estar subestimada. Alguns estudos de acompanhamento sobre a pneumonia por SARS-CoV-2 demonstraram que o AA também pode ser identificado meses após a infecção.(13)
A TC quantitativa tem sido utilizada para predizer desfechos clínicos de diversas doenças pulmonares, e a porcentagem de AA tem sido utilizada como uma das ferramentas quantitativas da TC na avaliação da asma, DPOC e doenças pulmonares intersticiais.(14-17) Com relação à COVID-19, poucos artigos avaliaram os achados quantitativos da TC como marcadores de progressão e prognóstico da doença. Descobriu-se que porcentagens crescentes de consolidação e OVF na TC de tórax estimam o risco de deterioração clínica ou morte em pacientes com pneumonia por COVID-19.(18) Além disso, foi relatado que a diminuição quantitativa do volume de pulmão bem aerado prediz resultados adversos na COVID-19.(19) Assim, o objetivo do presente estudo foi avaliar a doença das pequenas vias aéreas em pacientes com COVID-19 por meio da prevalência de AA e sua correlação com desfechos clínicos. Também foi avaliada a relação entre pequenos vasos sanguíneos com opacidades tomográficas e ventilação em pacientes com pneumonia por SARS-CoV-2.
MÉTODOS O conselho de revisão institucional aprovou este estudo transversal retrospectivo, e o consentimento livre e esclarecido foi dispensado. Foram incluídos retrospectivamente pacientes com teste de RT-PCR positivo para SARS-CoV-2 a partir de amostras de swab de garganta ou amostras do trato respiratório inferior entre 21 de março de 2020 e 20 de abril de 2020, em três hospitais. Os pacientes deveriam ter sido submetidos à TC de tórax no mesmo período do teste de RT-PCR positivo.
Foram obtidas imagens de TCAR volumétricas de todos os indivíduos, incluindo aquisições em inspiração máxima e ao final de uma expiração normal. A TC em fase expiratória já fazia parte do nosso protocolo institucional de TC para avaliação de infecções pulmonares antes da pandemia de COVID-19. Todas as imagens de TC foram realizadas com tensão de pico do tubo de 120 kVp e corrente fixa do tubo de 200 mAs para a TC inspiratória e de 50 mAs para a TC expiratória com tempo de rotação do gantry de 0,5 s. A espessura de corte reconstruída foi de 1,25 mm utilizando um tomógrafo de 64 canais (GE LightSpeed VCT; GE Healthcare, Chicago, IL, EUA).
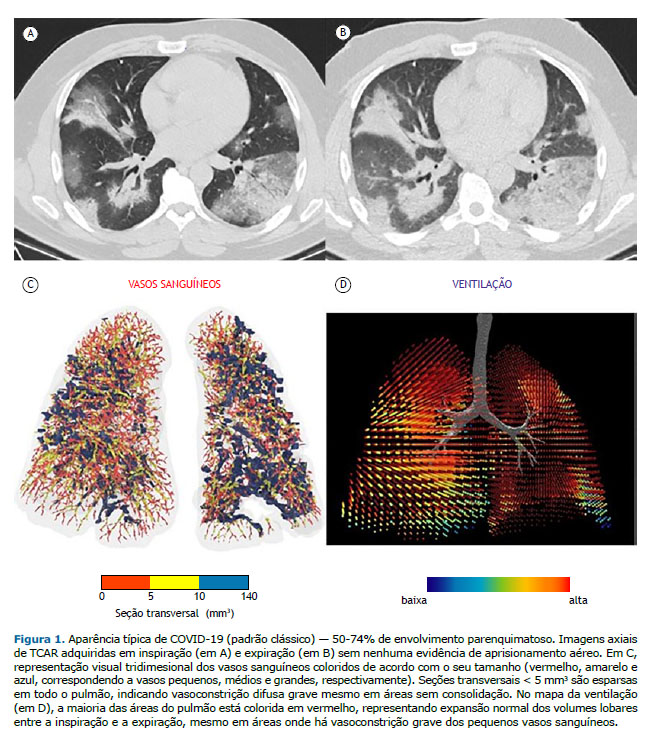
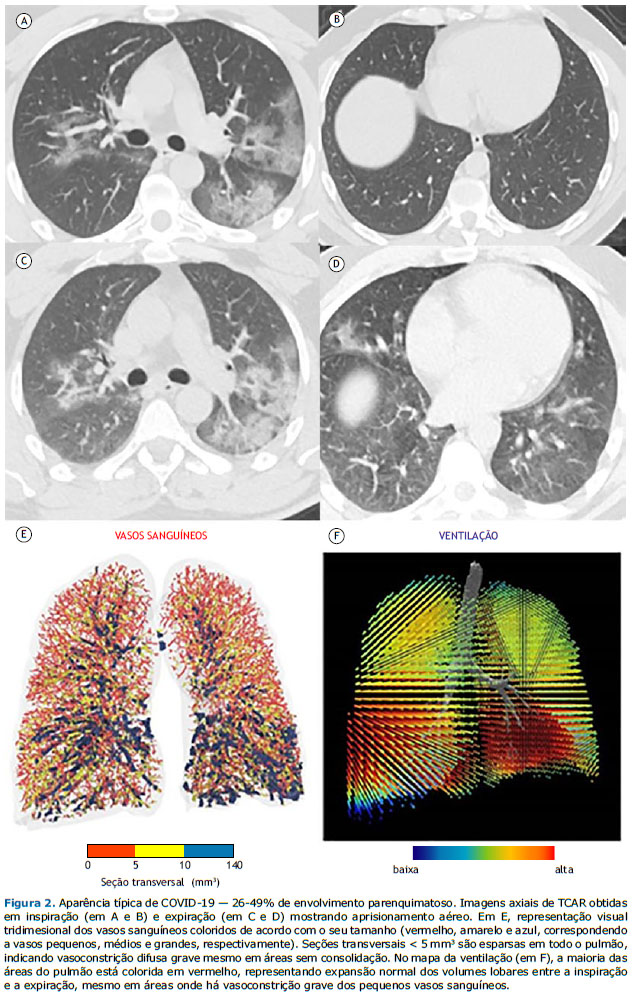
Os conjuntos de dados das TCAR inspiratórias e expiratórias foram analisados por meio de um sistema de banco de dados digital (CARESTREAM Vue PACS, versão 12.2.1.2; Carestream Health, Rochester, NY, EUA), e os dois radiologistas (com 5 e 9 anos de experiência) que realizaram a análise desconheciam os resultados clínicos e laboratoriais dos pacientes. A utilização de meios de contraste intravenosos foi solicitada a critério do médico assistente ou do radiologista. Os achados de TCAR foram descritos segundo a nomenclatura internacional padrão definida pelo glossário da Sociedade Fleischner(20) e a classificação da British Society of Thoracic Imaging de pneumonia por COVID-19 (clássico, provável, indeterminado ou não COVID-19).(21) Um escore semiquantitativo foi utilizado para estimar o envolvimento parenquimatoso com OVF e consolidação nas aquisições inspiratórias por meio das seguintes faixas de extensão de lesão: 0-24%, 25-49%, 50-74% e 75-100%. Os pacientes foram divididos em dois grupos com base na presença de AA, definido como áreas parenquimatosas com menos do que o aumento normal de atenuação e falta de redução de volume nas imagens de TC expiratória final.(20) Considerou-se AA regional presente quando pelo menos três lóbulos secundários estavam envolvidos, conforme descrito anteriormente.(22)
Os dados sobre as vias aéreas e os pequenas vasos também foram pós-processados por meio de análise de imagens respiratórias funcionais, técnica para avaliação da morfologia das vias aéreas que já foi extensivamente validada em seres humanos. (23 25) Reconstruções tridimensionais do pulmão e da vasculatura pulmonar foram criadas por meio de um software (FLUIDDA, Kontich, Bélgica) aprovado pela Food and Drug Administration dos EUA. Utilizando um algoritmo automatizado de segmentação de vasos sanguíneos descrito anteriormente,(26,27) calculamos o volume sanguíneo contido nos vasos em três faixas de seção transversal: < 5 mm3 (VS5); 5-10 mm3 (VS5-VS10) e > 10 mm3 (VS10). Foram criadas representações visuais tridimensionais dos vasos sanguíneos, as quais foram coloridas de acordo com o seu tamanho (Figuras 1 e 2). A partir dos dados derivados das imagens de TC inspiratória e expiratória de campo fechado, foram criados mapas da ventilação presumindo-se que as alterações regionais do volume pulmonar apresentariam relação com a ventilação regional, conforme descrito anteriormente.(28) Modelos de efeito misto também foram obtidos para representar o percentual previsto do VS5 em função do volume das opacidades tomográficas dentro de um lobo e da ventilação lobar.
As variáveis demográficas, clínicas e laboratoriais foram coletadas dos prontuários médicos eletrônicos das instituições. Esses parâmetros foram baseados em investigações anteriores que encontraram correlações entre essas variáveis e a gravidade da insuficiência respiratória em pacientes com COVID-19.(29,30)
Os dados foram apresentados como frequências absolutas e relativas, bem como médias e desvios padrão ou medianas e intervalos interquartis. O teste de Shapiro-Wilk foi utilizado para avaliar a normalidade da distribuição dos dados. Avaliamos associações entre variáveis com testes do qui-quadrado. Para comparar variáveis contínuas, utilizou-se o teste de Mann-Whitney. O teste t de Student foi utilizado para variáveis contínuas para comparações de dois grupos. Todos os testes foram bicaudais com nível de significância estabelecido em p < 0,05. As análises estatísticas foram realizadas por meio do programa Stata, versão 15 (Statacorp LP, College Station, TX, EUA).
RESULTADOS No total, foram incluídos 53 pacientes, sendo que o AA foi identificado em 23 (43,4%). Não houve diferenças significativas entre os pacientes com AA (grupo AA) e os sem AA (grupo não AA) quanto às características basais (Tabela 1). Ambos os grupos apresentaram prevalências semelhantes de comorbidades que causam AA, como asma e DPOC. De acordo com a classificação por imagem da pneumonia por COVID-19,(21) o padrão não COVID-19 foi identificado em 6 e 6 pacientes dos grupos AA e não AA, respectivamente (Tabela 1). Embora a maioria dos pacientes de ambos os grupos tenha apresentado o padrão clássico/provável COVID-19 na TC (Figura 1), não foram encontradas diferenças significativas entre os grupos quanto à prevalência dos padrões clássico/provável ou indeterminado para COVID-19 na TC (p = 0,196). A maioria dos pacientes incluídos em nosso estudo apresentou < 50% de envolvimento pulmonar nas imagens de TC. Embora as prevalências de ≥ 50% de envolvimento pulmonar tenham sido diferentes entre os grupos, as diferenças não foram estatisticamente significativas (p = 0,622).
A Tabela 2 resume a comparação dos desfechos entre os grupos. Houve diferenças significativas entre os grupos quanto à SpO2 na admissão e o nível de dímero D e quanto à necessidade de hospitalização. Na avaliação inicial, o grupo não AA apresentou menor SpO2 (p = 0,012) e maiores níveis de dímero D (p = 0,001) do que o grupo AA. Uma proporção maior de pacientes do grupo não AA necessitou de hospitalização em comparação aos do grupo AA (73,3% vs. 43,5%; p = 0,028).
A análise de regressão logística univariada comparou os desfechos entre os grupos. A presença de AA apresentou associação com SpO2 elevada em 25% na admissão (OR = 1,25; IC95%: 1,07-1,45; p = 0,004) e níveis reduzidos de dímero D (OR = 0,99; IC95%: 0,99-0,99; p = 0,039). Além disso, os pacientes com AA apresentaram menor probabilidade de hospitalização (OR = 0,27; IC95%: 0,08-0,89; p = 0,032).
Houve uma correlação inversa significativa, mas fraca, entre VS5 e opacidades lobares tomográficas (R2 = 0,19; p = 0,03; Figura 3). Além disso, houve uma correlação direta não significativa e fraca entre VS5 e ventilação lobar (R2 = 0,08; p = 0,54; Figura 4).
DISCUSSÃO No presente estudo, constatamos que o AA foi um achado comum entre os pacientes que foram submetidos à TC com aquisições expiratórias adicionais. Houve diferença significativa entre os pacientes com e sem AA quanto à SpO2 na admissão, níveis de dímero D e hospitalização, o que foi confirmado na análise de regressão univariada.
Estudos anteriores relataram prevalências de AA de até 64% em indivíduos com função pulmonar normal. (31) Tal prevalência é comparável à encontrada em nosso estudo (43,4%). Da mesma forma, apenas 17% dos pacientes incluídos apresentavam comorbidades que poderiam levar ao AA, como asma e DPOC.
Há relatos de que a redução dos vasos pulmonares periféricos apresenta correlação com piores desfechos clínicos na asma, DPOC e hipertensão pulmonar. (32 35) Na TC, a redução vascular periférica pode ser representada por menores volumes de VS5. Nosso estudo constatou que o percentual de VS5 dentro de um lobo pulmonar apresentou correlação inversa com o volume das opacidades lobares tomográficas, mas não com a ventilação lobar. Assim, áreas gravemente constritas ainda eram bem ventiladas. Esse achado corrobora a hipótese de hipóxia com complacência pulmonar preservada. Também corrobora Lins et al.,(26) que sugeriram que a COVID-19 é uma imitadora infecciosa da hipertensão pulmonar idiopática, uma vez que ambas as doenças podem apresentar coagulopatia microvascular e aumento da muscularização das artérias pulmonares.
O dímero D sérico é um marcador de lesão microvascular. Em pacientes com COVID-19, níveis mais elevados de dímero D estão relacionados a piores desfechos, insuficiência respiratória e embolia pulmonar. (29,30,36) Isso pode estar relacionado à maior ativação da coagulação sanguínea secundária a uma síndrome de resposta inflamatória sistêmica ou ser uma consequência direta da infecção por SARS-CoV-2. Nossos dados sugerem que pacientes com AA apresentam menor dano vascular e melhores desfechos. Isso pode estar relacionado ao fato de que pacientes com AA na TC de tórax apresentam “mais” doença das vias aéreas do que doença de pequenos vasos. Assim, nossa hipótese foi a de que pode haver dois fenótipos de pneumonia por SARS-CoV-2. Em primeiro lugar, o fenótipo de pequenos vasos, caracterizado por vasoconstrição grave e coagulopatia microvascular, que resulta em hipoxemia com complacência pulmonar preservada. Em segundo lugar, o fenótipo de pequenas vias aéreas, caracterizado por danos nas pequenas vias aéreas, representado nos exames de imagem pela presença de AA. Esses achados precisam ser confirmados por estudos maiores, e ainda é cedo para fazer recomendações sobre se as aquisições expiratórias devem ser incluídas nos exames de TC de todos os pacientes com pneumonia por COVID-19.
Em um estudo anterior com pacientes diagnosticados clinicamente com COVID-19,(6) o AA foi mais prevalente nos que haviam sido admitidos na UTI ou que morreram. No entanto, esse estudo teve várias limitações que devem ser reconhecidas, o que pode explicar a diferença entre seus resultados e os nossos. Em primeiro lugar, 34,4% de sua amostra apresentaram teste de RT-PCR negativo para SARS-CoV-2, o que enfraquece a associação entre AA e piores desfechos porque casos não COVID-19 podem ter sido incluídos. Em nosso estudo, todos os pacientes deviam apresentar teste de RT-PCR positivo para SARS-CoV-2. Em segundo lugar, eles incluíram uma amostra pequena de pacientes com desfechos ruins.
Nosso estudo tem algumas limitações. Em primeiro lugar, reconhecemos a natureza preliminar de nossos achados, incluindo a falta de um grupo de comparação com COVID-19 grave. Em segundo lugar, só pudemos incluir uma amostra pequena, principalmente em virtude de preocupações com a exposição dos pacientes à radiação adicional sem benefícios clínicos claros. Esses resultados preliminares podem encorajar novas investigações com amostras maiores a serem realizadas no futuro.
Em suma, constatamos que o AA é um achado comum em pacientes com COVID-19 submetidos à TC expiratória. O achado de AA pode apresentar correlação com SpO2 elevada na admissão, níveis reduzidos de dímero D e menor probabilidade de hospitalização. Além disso, o volume dos pequenos vasos pulmonares pode apresentar correlação negativa com opacidades tomográficas, mas não com ventilação lobar, sugerindo que áreas gravemente constritas ainda são bem ventiladas em pacientes com COVID-19.
CONTRIBUIÇÕES DOS AUTORES BH: autor responsável. RDC e BH: desenho do estudo. RDC, NV, GW, TM, SPLA, MZ, JDB, BRL, EM e BH: redação do manuscrito. RDC, JDB e BRL: aquisição dos dados. RDC, NV, TM, SPLA, MZ, EM, BH GW e BH: interpretação dos dados. RDC, NV, GW, TM, SPLA, MZ, JDB, BRL, EM e BH: revisão crítica e aprovação do manuscrito final.
CONFLITO DE INTERESSE Nenhum declarado.
REFERÊNCIAS 1. Higham A, Mathioudakis A, Vestbo J, Singh D. COVID-19 and COPD: a narrative review of the basic science and clinical outcomes. Eur Respir Rev. 2020;29(158):200199. https://doi.org/10.1183/16000617.0199-2020
2. Yang X, Yu Y, Xu J, Shu H, Xia J, Liu H, et al. Clinical course and outcomes of critically ill patients with SARS-CoV-2 pneumonia in Wuhan, China: a single-centered, retrospective, observational study [published correction appears in Lancet Respir Med. 2020 Apr;8(4):e26]. Lancet Respir Med. 2020;8(5):475-481. https://doi.org/10.1016/S2213-2600(20)30079-5
3. MacNee W. Pathology, pathogenesis, and pathophysiology. BMJ. 2006;332(7551):1202-4. https://doi.org/10.1136/bmj.332.7551.1202
4. Perez T, Chanez P, Dusser D, Devillier P. Small airway impairment in moderate to severe asthmatics without significant proximal airway obstruction. Respir Med. 2013;107(11):1667-1674. https://doi.org/10.1016/j.rmed.2013.08.009
5. Ussavarungsi K, Lee AS, Burger CD. Mosaic Pattern of Lung Attenuation on Chest CT in Patients with Pulmonary Hypertension. Diseases. 2015;3(3):205-212. https://doi.org/10.3390/diseases3030205
6. Erturk SM, Durak G, Ayyildiz H, Comert RG, Medetalibeyoglu A, Senkal N, et al. Covid-19: Correlation of Early Chest Computed Tomography Findings With the Course of Disease. J Comput Assist Tomogr. 2020;44(5):633-639. https://doi.org/10.1097/RCT.0000000000001073
7. Patel BV, Arachchillage DJ, Ridge CA, Bianchi P, Doyle JF, Garfield B, et al. Pulmonary Angiopathy in Severe COVID-19: Physiologic, Imaging, and Hematologic Observations. Am J Respir Crit Care Med. 2020;202(5):690-699. https://doi.org/10.1164/rccm.202004-1412OC
8. Guan WJ, Ni ZY, Hu Y, Liang WH, Ou CQ, He JX, et al. Clinical Characteristics of Coronavirus Disease 2019 in China. N Engl J Med. 2020;382(18):1708-1720. https://doi.org/10.1056/NEJMoa2002032
9. Ai T, Yang Z, Hou H, Zhan C, Chen C, Lv W, et al. Correlation of Chest CT and RT-PCR Testing for Coronavirus Disease 2019 (COVID-19) in China: A Report of 1014 Cases. Radiology. 2020;296(2):E32-E40. https://doi.org/10.1148/radiol.2020200642
10. Rubin GD, Ryerson CJ, Haramati LB, Sverzellati N, Kanne JP, Raoof S, et al. The Role of Chest Imaging in Patient Management During the COVID-19 Pandemic: A Multinational Consensus Statement From the Fleischner Society. Chest. 2020;158(1):106-116. https://doi.org/10.1016/j.chest.2020.04.003
11. Chung M, Bernheim A, Mei X, Zhang N, Huang M, Zeng X, et al. CT Imaging Features of 2019 Novel Coronavirus (2019-nCoV). Radiology. 2020;295(1):202-207. https://doi.org/10.1148/radiol.2020200230
12. Kwee TC, Kwee RM. Chest CT in COVID-19: What the Radiologist Needs to Know [published correction appears in Radiographics. 2022 Jan-Feb;42(1):E32]. Radiographics. 2020;40(7):1848-1865. https://doi.org/10.1148/rg.2020200159
13. Ebner L, Funke-Chambour M, von Garnier C, Ferretti G, Ghaye B, Beigelman-Aubry C. Imaging in the aftermath of COVID-19: what to expect. Eur Radiol. 2021;31(6):4390-4392. https://doi.org/10.1007/s00330-020-07465-6
14. Matsuoka S, Kurihara Y, Yagihashi K, Hoshino M, Watanabe N, Nakajima Y. Quantitative assessment of air trapping in chronic obstructive pulmonary disease using inspiratory and expiratory volumetric MDCT. AJR Am J Roentgenol. 2008;190(3):762-769. https://doi.org/10.2214/AJR.07.2820
15. Hochhegger B, Sanches FD, Altmayer SPL, Pacini GS, Zanon M, Guedes ÁDCB, et al. Air trapping in usual interstitial pneumonia pattern at CT: prevalence and prognosis. Sci Rep. 2018;8(1):17267. https://doi.org/10.1038/s41598-018-35387-3
16. Lee YK, Oh YM, Lee JH, Kim EK, Lee JH, Kim N, et al. Quantitative assessment of emphysema, air trapping, and airway thickening on computed tomography [published correction appears in Lung. 2008 Jul-Aug;186(4):277] [published correction appears in Lung. 2008 Aug;186(4):277]. Lung. 2008;186(3):157-165. https://doi.org/10.1007/s00408-008-9071-0
17. Hochhegger B, Zanon M, Altmayer S, Pacini GS, Balbinot F, Francisco MZ, et al. Advances in Imaging and Automated Quantification of Malignant Pulmonary Diseases: A State-of-the-Art Review. Lung. 2018;196(6):633-642. https://doi.org/10.1007/s00408-018-0156-0
18. Grodecki K, Lin A, Cadet S, McElhinney PA, Razipour A, Chan C, et al. Quantitative Burden of COVID-19 Pneumonia on Chest CT Predicts Adverse Outcomes: A Post-Hoc Analysis of a Prospective International Registry. Radiol Cardiothorac Imaging. 2020;2(5):e200389. https://doi.org/10.1148/ryct.2020200389
19. Colombi D, Bodini FC, Petrini M, Maffi G, Morelli N, Milanese G, et al. Well-aerated Lung on Admitting Chest CT to Predict Adverse Outcome in COVID-19 Pneumonia. Radiology. 2020;296(2):E86-E96. https://doi.org/10.1148/radiol.2020201433
20. Hansell DM, Bankier AA, MacMahon H, McLoud TC, Müller NL, Remy J. Fleischner Society: glossary of terms for thoracic imaging. Radiology. 2008;246(3):697-722. https://doi.org/10.1148/radiol.2462070712
21. Nair A, Rodrigues J, Hare S, Edey A, Devaraj A, Jacob J, et al. A British Society of Thoracic Imaging statement: considerations in designing local imaging diagnostic algorithms for the COVID-19 pandemic. Clin Radiol. 2020;75(5):329-334. https://doi.org/10.1016/j.crad.2020.03.008
22. Karimi R, Tornling G, Forsslund H., Mikko M, Wheelock ÅM, Nyrén S, et al. Differences in regional air trapping in current smokers with normal spirometry. Eur Respir J. 2017;49(1):1600345. https://doi.org/10.1183/13993003.00345-2016
23. De Backer JW, Vos WG, Vinchurkar SC, Claes R, Drollmann A, Wulfrank D, et al. Validation of computational fluid dynamics in CT-based airway models with SPECT/CT. Radiology. 2010;257(3):854-862. https://doi.org/10.1148/radiol.10100322
24. De Backer J, Vos W, Vinchurkar S, Van Holsbeke C, Poli G, Claes R, et al. The effects of extrafine beclometasone/formoterol (BDP/F) on lung function, dyspnea, hyperinflation, and airway geometry in COPD patients: novel insight using functional respiratory imaging. J Aerosol Med Pulm Drug Deliv. 2015;28(2):88-99. https://doi.org/10.1089/jamp.2013.1064
25. Hajian B, De Backer J, Vos W, Van Holsbeke C, Clukers J, De Backer W. Functional respiratory imaging (FRI) for optimizing therapy development and patient care. Expert Rev Respir Med. 2016;10(2):193-206. https://doi.org/10.1586/17476348.2016.1136216
26. Lins M, Vandevenne J, Thillai M, Lavon BR, Lanclus M, Bonte S, et al. Assessment of Small Pulmonary Blood Vessels in COVID-19 Patients Using HRCT. Acad Radiol. 2020;27(10):1449-1455. https://doi.org/10.1016/j.acra.2020.07.019
27. Rahaghi FN, Argemí G, Nardelli P, Domínguez-Fandos D, Arguis P, Peinado VI, et al. Pulmonary vascular density: comparison of findings on computed tomography imaging with histology. Eur Respir J. 2019;54(2):1900370. https://doi.org/10.1183/13993003.00370-2019
28. Bonte S, Lanclus M, Van Holsbeke C, De Backer J. Functional Respiratory Imaging (FRI) shows significant regional ventilation defects in COPD patients as compared to healthy data. Eur Respir J. 2020;56(Suppl. 64):2085. https://doi.org/10.1183/13993003.congress-2020.2085
29. Léonard-Lorant I, Delabranche X, Séverac F, Helms J, Pauzet C, Collange O, et al. Acute Pulmonary Embolism in Patients with COVID-19 at CT Angiography and Relationship to d-Dimer Levels. Radiology. 2020;296(3):E189-E191. https://doi.org/10.1148/radiol.2020201561
30. Zhang MQ, Wang XH, Chen YL, Zhao KL, Cai YQ, An CL, et al. Clinical features of 2019 novel coronavirus pneumonia in the early stage from a fever clinic in Beijing [Article in Chinese]. Zhonghua Jie He He Hu Xi Za Zhi. 2020;43(3):215-218.
31. Tanaka N, Matsumoto T, Miura G, Emoto T, Matsunaga N, Ueda K, et al. Air trapping at CT: high prevalence in asymptomatic subjects with normal pulmonary function. Radiology. 2003;227(3):776-785. https://doi.org/10.1148/radiol.2273020352
32. Ash SY, Rahaghi FN, Come CE, Ross JC, Colon AG, Cardet-Guisasola JC, et al. Pruning of the Pulmonary Vasculature in Asthma. The Severe Asthma Research Program (SARP) Cohort. Am J Respir Crit Care Med. 2018;198(1):39-50. https://doi.org/10.1164/rccm.201712-2426OC
33. Estépar RS, Kinney GL, Black-Shinn JL, Bowler RP, Kindlmann GL, Ross JC, et al. Computed tomographic measures of pulmonary vascular morphology in smokers and their clinical implications. Am J Respir Crit Care Med. 2013;188(2):231-239. https://doi.org/10.1164/rccm.201301-0162OC
34. Matsuoka S, Washko GR, Dransfield MT, Yamashiro T, San Jose Estepar R, Diaz A, et al. Quantitative CT measurement of cross-sectional area of small pulmonary vessel in COPD: correlations with emphysema and airflow limitation. Acad Radiol. 2010;17(1):93-99. https://doi.org/10.1016/j.acra.2009.07.022
35. Matsuoka S, Washko GR, Yamashiro T, Estepar RS, Diaz A, Silverman EK, et al. Pulmonary hypertension and computed tomography measurement of small pulmonary vessels in severe emphysema. Am J Respir Crit Care Med. 2010;181(3):218-225. https://doi.org/10.1164/rccm.200908-1189OC
36. Grillet F, Behr J, Calame P, Aubry S, Delabrousse E. Acute Pulmonary Embolism Associated with COVID-19 Pneumonia Detected with Pulmonary CT Angiography. Radiology. 2020;296(3):E186-E188. https://doi.org/10.1148/radiol.2020201544







