ABSTRACT
Historically, all efforts against tuberculosis were focused on rapid diagnosis and effective treatment to break the chain of transmission of Mycobacterium tuberculosis. However, in the last few years, more and more evidence has been found on the dramatic consequences of the condition defined as post-tuberculosis lung disease (PTLD). Approximately one third of patients surviving pulmonary tuberculosis face considerable ongoing morbidities, including respiratory impairment, psychosocial challenges, and reduced health-related quality of life after treatment completion. Given the important global and local burden of tuberculosis, as well as the estimated burden of PTLD, the development of a consensus document by a Brazilian scientific society-Sociedade Brasileira de Pneumologia e Tisiologia (SBPT)-was considered urgent for the prevention and management of this condition in order to allocate resources to and within tuberculosis services appropriately and serve as a guide for health care professionals. A team of eleven pulmonologists and one methodologist was created by the SBPT to review the current evidence on PTLD and develop recommendations adapted to the Brazilian context. The expert panel selected the topics on the basis of current evidence and international guidelines. During the first phase, three panel members drafted the recommendations, which were divided into three sections: definition and prevalence of PTLD, assessment of PTLD, and management of PTLD. In the second phase, all panel members reviewed, discussed, and revised the recommendations until a consensus was reached. The document was formally approved by the SBPT in a special session organized during the 2023 SBPT Annual Conference.
Keywords:
Tuberculosis; Post-infectious disorders; Disease management.
RESUMO
Historicamente, todos os esforços contra a tuberculose concentraram-se no diagnóstico rápido e no tratamento efetivo para quebrar a cadeia de transmissão do Mycobacterium tuberculosis. No entanto, nos últimos anos, têm sido encontradas mais e mais evidências sobre as dramáticas consequências da condição definida como doença pulmonar pós-tuberculose (DPPT). Aproximadamente um terço dos pacientes que sobrevivem à tuberculose pulmonar enfrenta morbidades consideráveis e persistentes, incluindo comprometimento respiratório, desafios psicossociais e redução da qualidade de vida relacionada à saúde após o término do tratamento. Diante da importante carga global e local da tuberculose, bem como da carga estimada da DPPT, considerou-se urgente o desenvolvimento de um documento de consenso por uma sociedade científica brasileira — a Sociedade Brasileira de Pneumologia e Tisiologia (SBPT) — para a prevenção e manejo dessa condição, a fim de alocar recursos de forma adequada para e nos serviços de tuberculose e servir de guia para os profissionais de saúde. Uma equipe de onze pneumologistas e um metodologista foi criada pela SBPT para revisar as evidências atuais sobre a DPPT e desenvolver recomendações adaptadas ao contexto brasileiro. O painel de especialistas selecionou os temas com base nas evidências atuais e diretrizes internacionais. Durante a primeira fase, três membros do painel redigiram as recomendações, que foram divididas em três seções: definição e prevalência de DPPT, avaliação da DPPT e manejo da DPPT. Na segunda fase, todos os membros do painel analisaram, discutiram e revisaram as recomendações até chegar a um consenso. O documento foi aprovado formalmente pela SBPT em sessão especial organizada durante o Congresso Anual da SBPT de 2023.
Palavras-chave:
Tuberculose; Transtornos pós-infecções; Gerenciamento clínico.
INTRODUÇÃO A tuberculose, além dos problemas físicos e psicológicos associados à doença, do estigma relacionado à doença e dos consideráveis custos financeiros, também acarreta uma condição definida como doença pulmonar pós-tuberculose (DPPT), que até agora tem sido pouco estudada, mas que recentemente ganhou destaque.(1)
Historicamente, todos os esforços contra a tuberculose concentraram-se no diagnóstico rápido e no tratamento efetivo, tentando quebrar a cadeia de transmissão do Mycobacterium tuberculosis. No entanto, nos últimos anos, o impacto das sequelas danosas de longo prazo causadas pela tuberculose pulmonar tem sido devidamente valorizado para pacientes individuais, seus contatos domiciliares, suas comunidades e os sistemas de saúde.(2)
Aproximadamente um terço dos pacientes que sobrevivem à tuberculose pulmonar enfrentam, após o término do tratamento, uma carga considerável e muitas vezes sub-reconhecida de morbidade persistente, incluindo comprometimento respiratório, desafios psicossociais e redução da qualidade de vida relacionada à saúde.(3,4) Até a mortalidade é maior em pacientes com DPPT, com risco de morte até seis vezes maior do que na população em geral.(5,6)
Apesar do recente aumento de publicações relacionadas à DPPT, os dados epidemiológicos da carga global e da morbidade associada à DPPT ainda são limitados em razão da falta de prioridade dos programas nacionais de tuberculose e da relativa complexidade da abordagem diagnóstica, que inclui, entre outros, avaliação clínica, radiológica e da função pulmonar.(7,8)
É evidente que as sequelas de DPPT contribuem para o excesso de mortalidade e morbidade,(9) causando incapacidades radiológicas e funcionais, favorecendo outras complicações (por exemplo: outras infecções, hemoptises etc.), prejudicando a qualidade de vida e, portanto, impulsionando a hospitalização e os custos para os sistemas de saúde. A avaliação e manejo precoce da morbidade por DPPT com base em recomendações sólidas de uma sociedade científica são de suma importância para garantir a alocação adequada de recursos para e nos serviços de tuberculose a fim de fornecer prevenção, diagnóstico e tratamento da DPPT com qualidade garantida.(3)
As presentes recomendações da Sociedade Brasileira de Pneumologia e Tisiologia (SBPT) se aplicam a pacientes com DPPT no contexto brasileiro. Um painel de 11 pneumologistas e um metodologista, incluindo dois especialistas internacionais, foi convidado pela SBPT para revisar o conhecimento atual sobre o tema e desenvolver recomendações específicas para o Brasil. Um painel de especialistas selecionou os temas com base nas evidências atuais e nas diretrizes internacionais disponíveis em julho de 2023. Durante a primeira fase, três membros do painel redigiram as recomendações, que foram divididas em três seções: descrição e prevalência da DPPT, avaliação da DPPT e manejo da DPPT. Na segunda fase, todos os membros do painel analisaram, discutiram e revisaram as recomendações até chegar a um consenso. O documento foi formalmente aprovado pela SBPT em sessão especial organizada durante o Congresso Anual da SBPT de 2023, realizado na cidade de Curitiba (PR).
DEFINIÇÃO A DPPT foi definida durante o Primeiro Simpósio Internacional sobre Doença Pós-Tuberculose, realizado em Stellenbosch, África do Sul, como “evidência de anormalidade respiratória crônica, com ou sem sintomas, atribuível, pelo menos em parte, à tuberculose (pulmonar) prévia”.(1) A DPPT inclui uma grande variedade de sequelas pulmonares funcionais e estruturais, desde distúrbios leves a graves. Cavitação, bronquiectasias, espessamento pleural, fibrose e hipertensão pulmonar são alguns exemplos de sequelas de tuberculose. Além disso, os pacientes podem sofrer colonização e infecção por Aspergillus fumigatus, micobactérias não tuberculosas e outras bactérias. (1,10-16) Os déficits de função pulmonar descritos em pacientes com DPPT incluem obstrução, restrição ou padrão misto, e aproximadamente 10% deles perdem mais da metade de sua função pulmonar.(17) De fato, em comparação com a população em geral, os pacientes com DPPT têm duas vezes mais chances de apresentar alterações espirométricas.(18) Como consequência das sequelas pulmonares, são frequentes os sintomas respiratórios persistentes, como dispneia, tosse, sibilância e redução da capacidade de exercício.(19)
EPIDEMIOLOGIA Apesar do recente aumento no número de publicações relacionadas à DPPT, a real carga epidemiológica da DPPT não é bem conhecida.(12) Estima-se que até 50% dos sobreviventes da tuberculose vivam com algum tipo de sequela.(20) Além disso, a taxa de mortalidade desse grupo de pacientes pode ser até 3-6 vezes maior em comparação com a da população em geral.(5,6,21)
De acordo com estudos anteriores, a prevalência de DPPT pode variar de 18% a 87%.(22) Essa grande variação pode ser atribuída aos diferentes cenários analisados e aos diversos parâmetros utilizados para o diagnóstico da DPPT. Em uma comparação recente de três diferentes estudos de coorte com pacientes com DPPT no Brasil, Itália e México, os testes de função pulmonar mostraram resultados diferentes, a maioria dos quais mostrou padrões obstrutivos, mistos e normais, respectivamente.(23)
Outro estudo utilizou padrões radiológicos para avaliar a prevalência de DPPT, e os resultados variaram de acordo com o tipo de exame (TC ou radiografia de tórax) e a alteração residual encontrada (cavitação, bronquiectasias, fibrose, nódulos, enfisema ou consolidação).(24)
As possíveis diferentes formas de caracterizar e definir a DPPT dificultam a generalização de vários estudos, e poucos dados podem correlacionar danos estruturais identificados em exames radiológicos de tórax, comprometimento funcional, sintomas respiratórios e qualidade de vida. Em 2022, uma meta-análise conduzida por Maleche-Obimbo et al.(25) identificou uma prevalência combinada de função pulmonar alterada, sintomas respiratórios persistentes e alterações radiológicas de 46,7%, 41,0% e 64,6%, respectivamente. A magnitude de qualquer tipo de DPPT variou de acordo com a sorologia para HIV, os contextos geográficos, os hábitos tabagísticos e os contextos urbanos/rurais.
AVALIAÇÃO DA DPPT Idealmente, todo paciente que termina o tratamento da tuberculose deve ser avaliado clinicamente para identificar sequelas pós-tuberculose o mais rápido possível.(26) Os exames/investigações essenciais recomendados para identificar a DPPT estão descritos no Quadro 1. É provável que nem todos esses exames/investigações possam ser realizados em muitos contextos. Nesse caso, alguns exames/investigações devem ser priorizados, principalmente naqueles pacientes com sintomas persistentes (Quadro 1).(1,4,10,12,22,26-32)
História e exame clínico Os padrões clínicos da DPPT incluem um amplo espectro de sinais e sintomas, variando de assintomático a incapacidade grave. Os sobreviventes da tuberculose geralmente apresentam alta prevalência de manifestações respiratórias como tosse crônica e dispneia.(33) O exame clínico deve se concentrar na frequência respiratória, frequência cardíaca e IMC de forma rotineira.(1)
Pacientes com alterações estruturais residuais podem apresentar exacerbações infecciosas e apresentam ainda maior risco de desenvolver tuberculose ativa novamente.(34) Doenças bacterianas, virais, fúngicas e micobacterianas não tuberculosas, que podem se complicar em razão de posterior hemoptise, podem ser graves e potencialmente fatais.(7) Os pacientes também apresentam altas taxas de hospitalização e de mortalidade respiratória.(33)
Vale ressaltar que outros fatores além de sequelas de tuberculose podem influenciar a DPPT e seus desfechos, como exposição ambiental ao tabagismo, abuso de substâncias, fumaça de biomassa e exposições ocupacionais. Além disso, as comorbidades cardiopulmonares e aquelas causadas por outras doenças também podem piorar os desfechos da DPPT.(1,7,22)
Exames de imagem de tórax Embora os exames de imagem de tórax sejam uma ferramenta importante para avaliar pacientes com DPPT, eles não devem ser utilizados isoladamente para definir dano pulmonar pós-tuberculose, pois os pacientes podem ser assintomáticos ou não apresentar comprometimento funcional e apresentar exames de imagem alterados indicando cura pós-tuberculose.(35)
Tanto a radiografia de tórax quanto a TC de tórax são úteis na avaliação de danos estruturais pulmonares em sobreviventes de tuberculose.(24) Embora a TC tenha se mostrado mais sensível na identificação de uma gama diversificada de patologias residuais,(24) a disponibilidade, os custos e o impacto da radiação da TC devem ser levados em consideração para decidir qual opção melhor se adapta a cada caso e cenário específico.
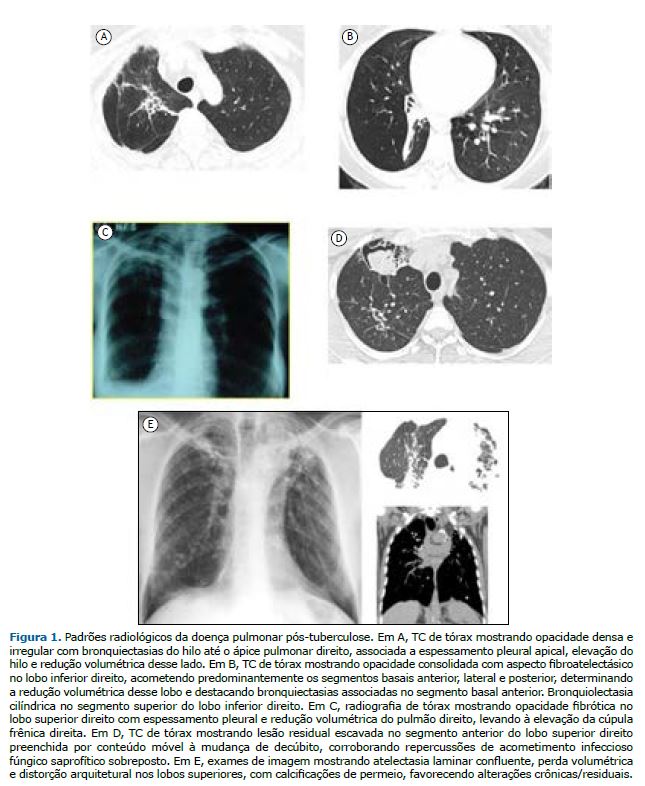
Os padrões radiológicos mais comuns da DPPT relatados em uma revisão sistemática foram cavitação, bronquiectasias e fibrose. Além disso, também podem ser observados nódulos, consolidação, enfisema, espessamento pleural e padrões em mosaico.(35) A Figura 1 apresenta alguns padrões radiológicos da DPPT.
Testes de função pulmonar Em 2015, um estudo denominado Burden of Obstructive Lung Disease(11) avaliou a associação entre comprometimento da função pulmonar e história de tuberculose em uma grande amostra internacional de base populacional e constatou que a tuberculose prévia associou-se tanto à obstrução do fluxo aéreo quanto à restrição espirométrica, devendo ser considerada uma causa potencialmente importante de doença obstrutiva e de redução da função pulmonar.
Até o momento, não há consenso sobre qual distúrbio é mais prevalente em indivíduos com sequelas de tuberculose. Um recente estudo de coorte prospectivo realizado no Malaui mostrou que 34,4% dos participantes apresentavam alterações na espirometria ao final do tratamento antituberculose.(33) Após 3 anos, 27,9% ainda apresentavam alterações nos testes de função pulmonar, principalmente de natureza obstrutiva (15,8%).(33)
O processo de cicatrização pelo qual os pulmões passam durante e após o tratamento antituberculose pode causar danos estruturais, levando à perda de tecido parenquimatoso e a padrão restritivo na espirometria. É menos claro quais mecanismos causam obstrução do fluxo aéreo associada à tuberculose. As duas hipóteses mais aceitas são (i) o desenvolvimento de doenças das vias aéreas (bronquiectasias e estenose brônquica) e (ii) fatores imunológicos que podem induzir hiper-responsividade brônquica.(11)
Portanto, sempre que a pletismografia ou as medidas de volumes pulmonares forem viáveis, elas devem complementar a espirometria para confirmar padrões obstrutivos, restritivos ou mesmo mistos de doença pulmonar, já que o tipo de defeito ventilatório pode ser heterogêneo e variar em diferentes populações.(23)
Reduções da DLCO podem ocorrer mesmo em pacientes com espirometria normal e podem ser uma ferramenta melhor para a avaliação da função pulmonar em pacientes com DPPT.(36) Além disso, também podem se correlacionar com o teste de exercício cardiopulmonar e predizer o consumo de oxigênio quando esse teste não estiver disponível.(37)
Assim como para a avaliação de outras doenças pulmonares e cardíacas, o teste de caminhada de seis minutos (TC6) auxilia na avaliação de pacientes com DPPT. Esse teste é barato, simples e muito útil para estudar limitações funcionais em sobreviventes de tuberculose e para elaborar programas de reabilitação adequados para pacientes com DPPT.(38)
Gasometria Em pacientes com incapacidades clínicas, radiológicas e/ou funcionais graves, a gasometria arterial (quando possível) ou mesmo a medição da saturação de oxigênio por oximetria de pulso podem identificar pacientes hipoxêmicos.
As indicações de oxigenoterapia domiciliar devem ser as mesmas que as para os pacientes com doenças crônicas das vias aéreas, ou seja, PaO2 < 55 mmHg, SpO2 < 88% em ar ambiente, PaO2 entre 56 e 59 mmHg associada a cor pulmonale e/ou hematócrito > 55%.(39)
Teste de exercício cardiopulmonar O teste de exercício cardiopulmonar fornece uma avaliação global das respostas integrativas ao exercício que envolvem os sistemas cardiovascular, respiratório, muscular e metabólico durante o esforço, sendo considerado o padrão ouro para avaliação funcional cardiorrespiratória.(40)
Em 2022, Curry et al.(37) constataram que, embora estatisticamente significativas, as correlações de quaisquer padrões de função pulmonar, se medidos por espirometria, DLCO ou mesmo pletismografia, com o consumo de oxigênio medido no teste de exercício cardiopulmonar, que é considerado o padrão ouro para medição da capacidade pulmonar, eram fracas. (1) Apesar de sua importância, o teste de exercício cardiopulmonar nem sempre está disponível.
Escores de sintomas e de qualidade de vida Escores de gravidade específicos ainda não estão disponíveis para pacientes com DPPT, mas há consenso sobre a urgência de um sistema de pontuação que avalie mortalidade, qualidade de vida relacionada à saúde, taxa de declínio da função pulmonar, exacerbações/hospitalizações e recidiva de tuberculose.(1)
Diferentes questionários de qualidade de vida relacionada à saúde estão disponíveis e devem ser utilizados no acompanhamento de pacientes com DPPT, como o St George’s Respiratory Questionnaire e o Short-Form Health Survey (com 12 ou 36 questões).(1,26)
Considerações específicas para crianças A avaliação ao final do tratamento deve seguir as mesmas recomendações propostas para adultos, embora faltem dados relativos a crianças. A TC de tórax geralmente não é indicada por causa da exposição à radiação, mas pode ser considerada em casos com sintomas crônicos e alterações radiológicas a fim de avaliar a extensão da doença e/ou excluir outros diagnósticos. Os testes de função pulmonar devem ser considerados em todas as crianças de 4 a 6 anos de idade com comprometimento pulmonar grave. Em crianças ≥ 4 anos de idade, a capacidade de exercício pode ser avaliada por meio do TC6. Questionários de qualidade de vida como o EQ-5D-Y e o instrumento Toddler and Infant (TANDI) podem ser utilizados com adaptações locais para crianças mais jovens.(26)
MANEJO DA DPPT Atualmente, não existem diretrizes baseadas em evidências para o manejo da DPPT, mas a crescente literatura científica sobre o tema tem levantado várias questões que podem auxiliar no acompanhamento desses pacientes(2,26)
Tratamento inalatório e oral Para aqueles com doença obstrutiva funcional estabelecida, os broncodilatadores inalatórios podem ser úteis para reduzir os sintomas de dispneia e prevenir o declínio da função pulmonar.(7) Apesar da ausência de evidências para se recomendar o uso rotineiro de broncodilatadores na DPPT, pequenos estudos sugeriram que os β2-agonistas de longa duração e os antagonistas muscarínicos de longa duração podem melhorar a função pulmonar e a dispneia.(7,24)
Os corticosteroides inalatórios devem ser evitados, pois podem aumentar a frequência de exacerbações e o risco de doenças micobacterianas.(41,42) No entanto, seguindo as recomendações aplicadas às bronquiectasias não císticas, em casos de DPPT associada à asma, a corticoterapia inalatória pode se justificar.(24) Da mesma forma, para inflamação crônica em pacientes com bronquiectasias não fibrose cística, recomenda-se o uso de macrolídeos por um período mínimo de 6-12 meses em pacientes com bronquiectasias e pelo menos duas exacerbações por ano.(39)
Complicações infecciosas A abordagem clínica das exacerbações de etiologia infecciosa e não infecciosa deve ser a mesma aplicada a bronquiectasias não fibrose cística.(39)
Além das infecções respiratórias de etiologia bacteriana e viral, as complicações fúngicas são frequentes nas sequelas pulmonares pós-tuberculose. O Aspergillus sp. pode se apresentar de diferentes formas e com diferentes níveis de gravidade desde apenas colonização na forma de bola fúngica (aspergiloma) até infiltração do parênquima pulmonar e/ou tecido pleural com destruição e novas cavidades (aspergilose pulmonar crônica).(7,32) Os critérios diagnósticos para esta última apresentação incluem a presença de sintomas respiratórios ou constitucionais há pelo menos 3 meses, achados radiológicos sugestivos e evidências sorológicas ou microbiológicas de Aspergillus sp. O tratamento dos aspergilomas em pacientes assintomáticos pode ser apenas de “observação”; entretanto, o manejo cirúrgico é necessário em casos com múltiplos episódios de hemoptise. Por outro lado, a invasão e destruição do parênquima pulmonar exigirão manejo antifúngico.(32) A prescrição de antifúngicos orais de longo prazo, como itraconazol na dose de 400 mg/dia ou voriconazol na dose de 400 mg/dia, administrados por pelo menos 6 meses, é a terapia de primeira linha recomendada para aspergilose pulmonar crônica e tem sido associada a melhora na qualidade de vida, alívio dos sintomas e atraso na progressão da doença.(43)
Reabilitação pulmonar Ex-pacientes de tuberculose com achados clínicos, funcionais ou radiológicos compatíveis com DPPT devem ser avaliados com vistas à reabilitação pulmonar (RP).(26) O Quadro 2 apresenta detalhadamente as indicações de RP, incluindo comprometimento da função pulmonar e/ou da DLCO(44); alterações na gasometria e/ou dessaturação noturna e dessaturação induzida pelo exercício(45); comprometimento da capacidade de exercício(1,38,46,47); sintomas respiratórios persistentes(48-51); tosse ineficaz e/ou dificuldade de eliminação de secreções brônquicas(52,53); pelo menos uma internação ou duas exacerbações nos últimos 12 meses(1,28,54,55); presença de comorbidades, incluindo DPOC, asma, bronquiectasias, fibrose pulmonar, hipertensão pulmonar e/ou necessidade de cirurgia(11,18,56); e comprometimento da qualidade de vida.(57-59)

O programa de RP deve ser coordenado de acordo com a organização local dos serviços de saúde, levando em consideração critérios de viabilidade, efetividade e custo-efetividade.(26) Os principais componentes do programa de RP estão resumidos no Quadro 3.
A avaliação da efetividade da RP deve ser realizada comparando as variáveis centrais antes e depois da RP,(26) conforme apresentado no Quadro 4.
Vacinação Tal como acontece com outras doenças respiratórias crônicas, a DPPT pode causar complicações infecciosas, e algumas delas podem ser prevenidas com vacinação. As vacinas contra influenza, pneumococos e COVID-19 devem ser recomendadas para pacientes com DPPT.
A vacinação contra influenza deve ser repetida anualmente seguindo as campanhas locais de vacinação. Para a prevenção pneumocócica, a Associação Brasileira de Imunizações recomenda a vacina pneumocócica conjugada 13-valente ou a vacina pneumocócica conjugada 15-valente, que tem efeito imunogênico mais forte o uso depende da disponibilidade e, 6 meses a 1 ano depois, a vacina pneumocócica polissacarídica 23-valente, que pode ser reforçada com uma segunda dose administrada 5 anos depois.(24)
Existem algumas vacinas recomendadas para a população em geral (ou grupos etários específicos) das quais os pacientes com DPPT provavelmente se beneficiarão, como aquelas contra tétano, difteria, coqueluche, sarampo e herpes zoster. A vacinação contra o sarampo é recomendada se não houver evidência de imunidade (por exemplo: nascimento antes de 1957, comprovação de vacinação contra sarampo-caxumba-rubéola ou evidência laboratorial de imunidade ou doença). Pacientes com DPPT > 50 anos de idade também podem se beneficiar da vacinação contra herpes zoster. A vacina contra tétano-difteria-coqueluche é recomendada para a população em geral e deve ser considerada para pacientes com DPPT não previamente vacinados; além disso, as doses de reforço devem ser repetidas a cada 10 anos em adultos.(60)
Educação e aconselhamento para pacientes com DPPT Todo paciente que participa de um programa de RP deve ser submetido a aconselhamento e educação em saúde. Os pacientes devem ser educados sobre os princípios básicos da doença (epidemiologia, aspectos clínicos, transmissão, diagnóstico e tratamento); sintomas comuns que podem apresentar após a doença aguda; como monitorar e manejar os sintomas em casa e quando devem procurar um serviço de saúde/chamar um médico; e riscos de reinfecção e como podem gerir esse risco. Além disso, os pacientes devem ser aconselhados sobre os benefícios de um estilo de vida saudável (como atividade física, nutrição adequada e cessação do tabagismo). A telessaúde, vídeos e cartilhas podem ser utilizados para a educação do paciente. Os familiares dos pacientes também devem ser incentivados a participar. O aconselhamento/educação em saúde deve incluir a manutenção dos resultados obtidos com a RP, por meio de um plano de acompanhamento.(26,61)
CONSIDERAÇÕES FINAIS À medida que mais e mais evidências estão disponíveis sobre as consequências deletérias da DPPT, o desenvolvimento de um consenso direcionado a essa condição tornou-se uma prioridade para a SBPT. Aproximadamente um terço dos pacientes que sobrevivem à tuberculose pulmonar pode enfrentar uma morbidade considerável e contínua, e as presentes recomendações aplicam-se a eles. No presente manuscrito, elaborado por 11 pneumologistas e um metodologista com vasta experiência nessa área, foram feitas recomendações para prevenção, diagnóstico e manejo, e as últimas diretrizes internacionais foram adaptadas ao contexto brasileiro.
AGRADECIMENTOS Gostaríamos de agradecer o apoio de Lia D’Ambrosio (Grupo de Consultoria em Saúde Pública, Lugano, Suíça) e Rosella Centis (Istituti Clinici Scientifici Maugeri, IRCCS, Tradate, Itália), que forneceram comentários úteis sobre o manuscrito.
CONTRIBUIÇÕES DOS AUTORES DRS, APS, GBM e FCQM: redação do manuscrito. Todos os autores revisaram e aprovaram a versão final do manuscrito.
CONFLITOS DE INTERESSE Nenhum declarado.
REFERÊNCIAS 1. Allwood BW, van der Zalm MM, Amaral AFS, Byrne A, Datta S, Egere U, et al. Post-tuberculosis lung health: perspectives from the First International Symposium. Int J Tuberc Lung Dis. 2020;24(8):820-828. https://doi.org/10.5588/ijtld.20.0067
2. van Kampen SC, Wanner A, Edwards M, Harries AD, Kirenga BJ, Chakaya J, et al. International research and guidelines on post-tuberculosis chronic lung disorders: a systematic scoping review. BMJ Glob Health. 2018;3(4):e000745. https://doi.org/10.1136/bmjgh-2018-000745
3. van Kampen SC, Wanner A, Edwards M, Harries AD, Kirenga BJ, Chakaya J, et al. International research and guidelines on post-tuberculosis chronic lung disorders: a systematic scoping review. BMJ Glob Health. 2018;3(4):e000745. https://doi.org/10.1136/bmjgh-2018-000745
4. Nightingale R, Carlin F, Meghji J, McMullen K, Evans D, van der Zalm MM, et al. Post-TB health and wellbeing. Int J Tuberc Lung Dis. 2023;27(4):248-283. https://doi.org/10.5588/ijtld.22.0514
5. Romanowski K, Baumann B, Basham CA, Ahmad Khan F, Fox GJ, Johnston JC. Long-term all-cause mortality in people treated for tuberculosis: a systematic review and meta-analysis. Lancet Infect Dis. 2019;19(10):1129-1137. https://doi.org/10.1016/S1473-3099(19)30309-3
6. Ranzani OT, Rodrigues LC, Bombarda S, Minto CM, Waldman EA, Carvalho CRR. Long-term survival and cause-specific mortality of patients newly diagnosed with tuberculosis in São Paulo state, Brazil, 2010-15: a population-based, longitudinal study. Lancet Infect Dis. 2020;20(1):123-132. https://doi.org/10.1016/S1473-3099(19)30518-3
7. Allwood BW, Byrne A, Meghji J, Rachow A, van der Zalm MM, Schoch OD. Post-Tuberculosis Lung Disease: Clinical Review of an Under-Recognised Global Challenge. Respiration. 2021;100(8):751-763. https://doi.org/10.1159/000512531
8. Visca D, D Ambrosio L, Centis R, Pontali E, Tiberi S, Migliori GB. Post-TB disease: a new topic for investigation-and why it matters. Int J Tuberc Lung Dis. 2021;25(4):258-261. https://doi.org/10.5588/ijtld.21.0040
9. Dodd PJ, Yuen CM, Jayasooriya SM, van der Zalm MM, Seddon JA. Quantifying the global number of tuberculosis survivors: a modelling study. Lancet Infect Dis. 2021;21(7):984-992. https://doi.org/10.1016/S1473-3099(20)30919-1
10. Pasipanodya JG, McNabb SJ, Hilsenrath P, Bae S, Lykens K, Vecino E, et al. Pulmonary impairment after tuberculosis and its contribution to TB burden. BMC Public Health. 2010;10:259. https://doi.org/10.1186/1471-2458-10-259
11. Amaral AF, Coton S, Kato B, Tan WC, Studnicka M, Janson C, et al. Tuberculosis associates with both airflow obstruction and low lung function: BOLD results. Eur Respir J. 2015;46(4):1104-1112. https://doi.org/10.1183/13993003.02325-2014
12. Allwood BW, Stolbrink M, Baines N, Louw E, Wademan DT, Lupton-Smith A, et al. Persistent chronic respiratory symptoms despite TB cure is poorly correlated with lung function. Int J Tuberc Lung Dis. 2021;25(4):262-270. https://doi.org/10.5588/ijtld.20.0906
13. Menzies NA, Quaife M, Allwood BW, Byrne AL, Coussens AK, Harries AD, et al. Lifetime burden of disease due to incident tuberculosis: a global reappraisal including post-tuberculosis sequelae [published correction appears in Lancet Glob Health. 2022 Mar;10(3):e336]. Lancet Glob Health. 2021;9(12):e1679-e1687. https://doi.org/10.1016/S2214-109X(21)00367-3
14. Pontali E, Silva DR, Marx FM, Caminero JA, Centis R, D’Ambrosio L, et al. Breathing Back Better! A State of the Art on the Benefits of Functional Evaluation and Rehabilitation of Post-Tuberculosis and Post-COVID Lungs. Arch Bronconeumol. 2022;58(11):754-763. https://doi.org/10.1016/j.arbres.2022.05.010
15. Martinez-Garcia MA, Guan WJ, de-la-Rosa D, Athanazio R, Oscullo G, Shi MX, et al. Post-TB bronchiectasis: from pathogenesis to rehabilitation. Int J Tuberc Lung Dis. 2023;27(3):175-181. https://doi.org/10.5588/ijtld.22.0566
16. Hsu D, Irfan M, Jabeen K, Iqbal N, Hasan R, Migliori GB, et al Post tuberculosis treatment infectious complications. Int J Infect Dis. 2020;92S:S41-S45. https://doi.org/10.1016/j.ijid.2020.02.032
17. Pasipanodya JG, Miller TL, Vecino M, Munguia G, Garmon R, Bae S, et al Pulmonary impairment after tuberculosis. Chest. 2007;131(6):1817-1824. https://doi.org/10.1378/chest.06-2949
18. Tiberi S, Torrico MM, Rahman A, Krutikov M, Visca D, Silva DR, et al. Managing severe tuberculosis and its sequelae: from intensive care to surgery and rehabilitation. J Bras Pneumol. 2019;45(2):e20180324. https://doi.org/10.1590/1806-3713/e20180324
19. Migliori GB, Caminero Luna J, Kurhasani X, van den Boom M, Visca D, D’Ambrosio L, et al. History of prevention, diagnosis, treatment and rehabilitation of pulmonary sequelae of tuberculosis. Presse Med. 2022;51(3):104112. https://doi.org/10.1016/j.lpm.2022.104112
20. Mpagama SG, Msaji KS, Kaswaga O, Zurba LJ, Mbelele PM, Allwood BW, et al. The burden and determinants of post-TB lung disease. Int J Tuberc Lung Dis. 2021;25(10):846-853. https://doi.org/10.5588/ijtld.21.0278
21. Miller TL, Wilson FA, Pang JW, Beavers S, Hoger S, Sharnprapai S, et al. Mortality hazard and survival after tuberculosis treatment. Am J Public Health. 2015;105(5):930-937. https://doi.org/10.2105/AJPH.2014.302431
22. Ravimohan S, Kornfeld H, Weissman D, Bisson GP. Tuberculosis and lung damage: from epidemiology to pathophysiology. Eur Respir Rev. 2018;27(147):170077. https://doi.org/10.1183/16000617.0077-2017
23. Silva DR, Freitas AA, Guimarães AR, D’Ambrosio L, Centis R, Muñoz-Torrico M, et al. Post-tuberculosis lung disease: a comparison of Brazilian, Italian, and Mexican cohorts. J Bras Pneumol. 2022;48(2):e20210515.
24. Meghji J, Simpson H, Squire SB, Mortimer K. A Systematic Review of the Prevalence and Pattern of Imaging Defined Post-TB Lung Disease. PLoS One. 2016;11(8):e0161176. https://doi.org/10.1371/journal.pone.0161176
25. Maleche-Obimbo E, Odhiambo MA, Njeri L, Mburu M, Jaoko W, Were F, et al. Magnitude and factors associated with post-tuberculosis lung disease in low- and middle-income countries: A systematic review and meta-analysis. PLOS Glob Public Health. 2022;2(12):e0000805. https://doi.org/10.1371/journal.pgph.0000805
26. Migliori GB, Marx FM, Ambrosino N, Zampogna E, Schaaf HS, van der Zalm MM, et al. Clinical standards for the assessment, management and rehabilitation of post-TB lung disease. Int J Tuberc Lung Dis. 2021;25(10):797-813. https://doi.org/10.5588/ijtld.21.0425
27. Chesov D, Butov D, Reimann M, Heyckendorf J, Myasoedov V, Butov T, et al. Impact of lung function on treatment outcome in patients with TB. Int J Tuberc Lung Dis. 2021;25(4):277-284. https://doi.org/10.5588/ijtld.20.0949
28. Muñoz-Torrico M, Rendon A, Centis R, D’Ambrosio L, Fuentes Z, Torres-Duque C, et al. Is there a rationale for pulmonary rehabilitation following successful chemotherapy for tuberculosis?. J Bras Pneumol. 2016;42(5):374-385. https://doi.org/10.1590/S1806-37562016000000226
29. Tiberi S, Torrico MM, Rahman A, Krutikov M, Visca D, Silva DR, et al. Managing severe tuberculosis and its sequelae: from intensive care to surgery and rehabilitation. J Bras Pneumol. 2019;45(2):e20180324. https://doi.org/10.1590/1806-3713/e20180324
30. Muñoz-Torrico M, Cid-Juárez S, Gochicoa-Rangel L, Torre-Bouscolet L, Salazar-Lezama MA, Villarreal-Velarde H, et al. Functional impact of sequelae in drug-susceptible and multidrug-resistant tuberculosis. Int J Tuberc Lung Dis. 2020;24(7):700-705. https://doi.org/10.5588/ijtld.19.0809
31. Ross J, Ehrlich RI, Hnizdo E, White N, Churchyard GJ. Excess lung function decline in gold miners following pulmonary tuberculosis. Thorax. 2010;65(11):1010-1015. https://doi.org/10.1136/thx.2009.129999
32. Bongomin F. Post-tuberculosis chronic pulmonary aspergillosis: An emerging public health concern. PLoS Pathog. 2020;16(8):e1008742. https://doi.org/10.1371/journal.ppat.1008742
33. Nightingale R, Chinoko B, Lesosky M, Rylance SJ, Mnesa B, Banda NPK, et al. Respiratory symptoms and lung function in patients treated for pulmonary tuberculosis in Malawi: a prospective cohort study. Thorax. 2022;77(11):1131-1139. https://doi.org/10.1136/thoraxjnl-2021-217190
34. Marx FM, Floyd S, Ayles H, Godfrey-Faussett P, Beyers N, Cohen T. High burden of prevalent tuberculosis among previously treated people in Southern Africa suggests potential for targeted control interventions. Eur Respir J. 2016;48(4):1227-1230. https://doi.org/10.1183/13993003.00716-2016
35. Singh S, Allwood BW, Chiyaka TL, Kleyhans L, Naidoo CC, Moodley S, et al. Immunologic and imaging signatures in post tuberculosis lung disease. Tuberculosis (Edinb). 2022;136:102244. https://doi.org/10.1016/j.tube.2022.102244
36. Gupta MB, Bagri S, Garg A, Singh DK, Choudhary P, Sahni S. Pulmonary function in cured pulmonary tuberculosis cases. Indian J Tuberc. 2022;69(4):535-538. https://doi.org/10.1016/j.ijtb.2021.08.024
37. Curry BD, van T Wout E, Maasdorp E, Nortje A, Irusen EM, Maree D, et al. Correlation between lung function tests and peak oxygen consumption in post-TB lung disease. Int J Tuberc Lung Dis. 2022;26(3):259-267. https://doi.org/10.5588/ijtld.21.0504
38. Sivaranjini S, Vanamail P, Eason J. Six minute walk test in people with tuberculosis sequelae. Cardiopulm Phys Ther J. 2010;21(3):5-10. https://doi.org/10.1097/01823246-201021030-00002
39. Pereira MC, Athanazio RA, Dalcin PTR, Figueiredo MRF, Gomes M, Freitas CG, et al. Brazilian consensus on non-cystic fibrosis bronchiectasis. J Bras Pneumol. 2019;45(4):e20190122. https://doi.org/10.1590/1806-3713/e20190122
40. American Thoracic Society; American College of Chest Physicians. ATS/ACCP Statement on cardiopulmonary exercise testing [published correction appears in Am J Respir Crit Care Med. 2003 May 15;1451-2]. Am J Respir Crit Care Med. 2003;167(2):211-277. https://doi.org/10.1164/rccm.167.2.211
41. Venkitakrishnan R, Ramachandran D, Augustine J, Cleetus M. Inhaled corticosteroids and risk of tuberculosis-How bad is the risk?. Indian J Tuberc. 2022;69(2):128-130. https://doi.org/10.1016/j.ijtb.2021.06.010
42. Martínez-García MÁ, Oscullo G, García-Ortega A, Matera MG, Rogliani P, Cazzola M. Inhaled Corticosteroids in Adults with Non-cystic Fibrosis Bronchiectasis: From Bench to Bedside. A Narrative Review. Drugs. 2022;82(14):1453-1468. https://doi.org/10.1007/s40265-022-01785-1
43. Bongomin F, Harris C, Hayes G, Kosmidis C, Denning DW. Twelve-month clinical outcomes of 206 patients with chronic pulmonary aspergillosis. PLoS One. 2018;13(4):e0193732. https://doi.org/10.1371/journal.pone.0193732
44. Pellegrino R, Viegi G, Brusasco V, Crapo RO, Burgos F, Casaburi R, et al. Interpretative strategies for lung function tests. Eur Respir J. 2005;26(5):948-968. https://doi.org/10.1183/09031936.05.00035205
45. Crapo RO, Jensen RL, Hegewald M, Tashkin DP. Arterial blood gas reference values for sea level and an altitude of 1,400 meters. Am J Respir Crit Care Med. 1999;160(5 Pt 1):1525-1531. https://doi.org/10.1164/ajrccm.160.5.9806006
46. Holland AE, Spruit MA, Troosters T, Puhan MA, Pepin V, Saey D, et al. An official European Respiratory Society/American Thoracic Society technical standard: field walking tests in chronic respiratory disease. Eur Respir J. 2014;44(6):1428-1446. https://doi.org/10.1183/09031936.00150314
47. Jones SE, Kon SS, Canavan JL, Patel MS, Clark AL, Nolan CM, et al. The five-repetition sit-to-stand test as a functional outcome measure in COPD. Thorax. 2013;68(11):1015-1020. https://doi.org/10.1136/thoraxjnl-2013-203576
48. Grønseth R, Vollmer WM, Hardie JA, Ólafsdóttir IS, Lamprecht B, Buist AS, et al. Predictors of dyspnoea prevalence: results from the BOLD study. Eur Respir J. 2014;43(6):1610-1620. https://doi.org/10.1183/09031936.00036813
49. Bestall JC, Paul EA, Garrod R, Garnham R, Jones PW, Wedzicha JA. Usefulness of the Medical Research Council (MRC) dyspnoea scale as a measure of disability in patients with chronic obstructive pulmonary disease. Thorax. 1999;54(7):581-586. https://doi.org/10.1136/thx.54.7.581
50. Borg GA. Psychophysical bases of perceived exertion. Med Sci Sports Exerc. 1982;14(5):377-381. https://doi.org/10.1249/00005768-198205000-00012
51. Gift AG. Validation of a vertical visual analogue scale as a measure of clinical dyspnea. Rehabil Nurs. 1989;14(6):323-325. https://doi.org/10.1002/j.2048-7940.1989.tb01129.x
52. Sancho J, Servera E, Díaz J, Marín J. Comparison of peak cough flows measured by pneumotachograph and a portable peak flow meter. Am J Phys Med Rehabil. 2004;83(8):608-612. https://doi.org/10.1097/01.PHM.0000133431.70907.A2
53. American Thoracic Society/European Respiratory Society. ATS/ERS Statement on respiratory muscle testing. Am J Respir Crit Care Med. 2002;166(4):518-624. https://doi.org/10.1164/rccm.166.4.518
54. Kim SJ, Lee J, Park YS, Lee CH, Lee SM, Yim JJ, et al. Effect of airflow limitation on acute exacerbations in patients with destroyed lungs by tuberculosis. J Korean Med Sci. 2015;30(6):737-742. https://doi.org/10.3346/jkms.2015.30.6.737
55. Global Initiative for Chronic Obstructive Lung Disease (GOLD) [homepage on the Internet]. Bethesda: GOLD [cited 2023 May 29]. 2020 Global Strategy for Prevention, Diagnosis and Management of COPD: 2023 Report. Available from: https://goldcopd.org/2023-gold-report-2/
56. Linn BS, Linn MW, Gurel L. Cumulative illness rating scale. J Am Geriatr Soc. 1968;16(5):622-626. https://doi.org/10.1111/j.1532-5415.1968.tb02103.x
57. Datta S, Gilman RH, Montoya R, Quevedo Cruz L, Valencia T, Huff D, et al. Quality of life, tuberculosis and treatment outcome; a case-control and nested cohort study. Eur Respir J. 2020;56(2):1900495. https://doi.org/10.1183/13993003.00495-2019
58. Silva PA, Soares SM, Santos JF, Silva LB. Cut-off point for WHOQOL-bref as a measure of quality of life of older adults. Rev Saude Publica. 2014;48(3):390-397. https://doi.org/10.1590/S0034-8910.2014048004912
59. Jo YS, Park S, Kim DK, Yoo CG, Lee CH. The cutoff point of clinical chronic obstructive pulmonary disease questionnaire for more symptomatic patients. BMC Pulm Med. 2018;18(1):38. https://doi.org/10.1186/s12890-018-0601-0
60. Nasiri MJ, Silva DR, Rommasi F, Zahmatkesh MM, Tajabadi Z, Khelghati F, et al. Vaccination in post-tuberculosis lung disease management: A review of the evidence [published online ahead of print, 2023 Sep 5]. Pulmonology. 2023;S2531-0437(23)00129-0. https://doi.org/10.1016/j.pulmoe.2023.07.002
61. Siddiq MAB, Rathore FA, Clegg D, Rasker JJ. Pulmonary Rehabilitation in COVID-19 pa-tients: A scoping review of current practice and its application during the pandemic. Turk J Phys Med Rehabil. 2020;66(4):480-494. https://doi.org/10.5606/tftrd.2020.6889