ABSTRACT
Negative-pressure pulmonary edema accompanied by hemorrhage as a manifestation of upper airway obstruction is an uncommon
problem that is potentially life-threatening. The principal pathophysiological mechanism involved is the generation of markedly negative
intrathoracic pressure, which leads to an increase in pulmonary vascular volume and pulmonary capillary transmural pressure, creating a
risk of disruption of the alveolar-capillary membrane. We report the case of an adult male with diffuse alveolar hemorrhage following acute
upper airway obstruction caused by the formation of a cervical and mediastinal abscess resulting from the insertion of a metallic tracheal
stent. The patient was treated through drainage of the abscess, antibiotic therapy, and positive pressure mechanical ventilation. This article
emphasizes the importance of including this entity in the differential diagnosis of acute lung injury after procedures involving upper airway
instrumentation.
Keywords:
Hemorrhage; Pulmonary edema; Airway obstruction; Abscess; Prostheses and implants.
RESUMO
O edema pulmonar por pressão negativa associado à hemorragia como manifestação de obstrução das vias aéreas superiores é um problema
incomum com potencial risco de morte. O principal mecanismo fisiopatológico envolvido é a geração de uma acentuada pressão negativa
intratorácica que eleva tanto o volume vascular como a pressão transmural capilar pulmonar, causando risco de ruptura da membrana
alvéolo-capilar. Relatamos o caso de um paciente do sexo masculino com hemorragia alveolar difusa após obstrução aguda das vias aéreas
superiores causada pela formação de um abscesso cervical e mediastinal decorrente do implante de uma órtese traqueal metálica. O paciente
foi tratado com drenagem do abscesso, antibioticoterapia e ventilação mecânica com pressão positiva. Este artigo enfatiza a importância de
incluir essa entidade no diagnóstico diferencial da lesão pulmonar aguda após procedimentos que envolvam a manipulação das vias aéreas
superiores.
Palavras-chave:
Hemorragia; Edema pulmonar; Obstrução das vias respiratórias; Abscesso; Próteses e implantes.
IntroduçãoO edema pulmonar por pressão negativa (EPPN) é uma entidade conhecida, embora incomum, relacionada à obstrução das vias aéreas superiores. É freqüentemente subdiagnosticado e potencialmente letal. Ocorre com maior freqüência em situações de laringoespasmo após procedimentos com anestesia geral.(1)
A patogênese do EPPN é multifatorial, e a intensa pressão negativa intratorácica associada à obstrução das vias aéreas superiores tem um papel importante.
A hemorragia pulmonar por pressão negativa tem sido raramente relatada.(2,3)
Relatamos um caso de hemorragia pulmonar por pressão negativa relacionada a processo obstrutivo das vias aéreas superiores causado por um abscesso cervical e mediastinal após o implante de uma órtese traqueal metálica auto-expansível para tratamento de estenose traqueal pós-intubação.
Relato do casoPaciente do sexo masculino de 25 anos, atleta profissional, portador de estenose traqueal pós-intubação foi submetido à dilatação da traquéia seguida da colocação de uma órtese metálica auto-expansível no terço superior da traquéia.
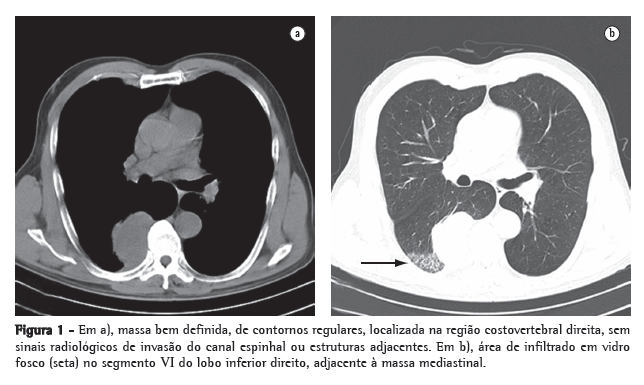
Sete dias após o implante, apresentou quadro febril associado a enfisema subcutâneo na região cervical. O leucograma apresentou 25.000 leucócitos com 8% de bastonetes. A tomografia computadorizada cervical mostrou abaulamento acentuado da parede posterior da traquéia logo abaixo da órtese traqueal (Figuras 1a e 1b). A broncofibroscopia sob sedação com midazolan 3,0 mg e anestesia tópica laringotraqueal com lidocaína a 1% mostrou que a órtese estava adequadamente posicionada e que havia um abaulamento significativo da parede membranosa na sua extremidade inferior. Durante o procedimento não houve sangramento ou quaisquer outras intercorrências, sendo administrados 500 mL de soro fisiológico para reposição volêmica. Ao término do exame endoscópico o paciente apresentou quadro de insuficiência respiratória, com cornagem, sugerindo a existência de um processo obstrutivo das vias aéreas superiores exigindo vigoroso esforço inspiratório. Esse quadro foi tratado inicialmente com máscara de oxigênio a 10 L/min e corticosteróide endovenoso.
Não havendo melhora do quadro clínico, foi submetido à intubação translaríngea com cânula 7 F através do implante metálico. Observou-se imediata saída de secreção hemorrágica em grande quantidade pela cânula orotraqueal.
A gasometria arterial com fração inspirada de oxigênio (FiO2) de 1,0 revelou: pH, 7,35; pressão parcial de gás carbônico (PCO2), 39 mmHg; pressão parcial de oxigênio (PO2), 80 mmHg; bicarbonato (HCO3), 20; excesso de bases (do inglês base excess-BE), −3,3; e saturação arterial de oxigênio (SaO2), 87%. O eletrocardiograma mostrou ritmo sinusal sem anormalidades. O radiograma de tórax na sala operatória revelou consolidação pulmonar bilateral mais localizada em campos superiores e médios, sem sinais de cardiomegalia (Figura 2a). Nesse momento, a ausculta pulmonar apresentou estertores difusos e bilaterais com distribuição compatível com o quadro radiológico. Um segundo exame broncofibroscópico mostrou sangramento difuso proveniente dos óstios lobares, com predomínio dos óstios superiores.

Diante da estabilidade da insuficiência respiratória, optou-se pela imediata drenagem do abscesso cervical por meio de cervicotomia ântero-lateral direita, seguida da instalação de sonda Foley de 3 vias para a irrigação contínua pós-operatória.
Durante todo o procedimento, não houve instabilidade hemodinâmica, com pressão arterial média entre 85-90 mmHg e pressão venosa central entre 5-7 cm H2O. A oximetria de pulso oscilou entre 80-85%, com FiO2 de 1,0 em ventilação mecânica controlada.
O paciente foi conduzido à unidade de terapia intensiva e permaneceu sob sedação e ventilação mecânica contínua, sem o uso de diuréticos. O radiograma de tórax e a gasometria arterial revelaram melhora progressiva, sendo gradativamente reduzido o suporte ventilatório. O paciente foi extubado no 3º dia pós-operatório.
No 5º dia de evolução, foi submetido à tomografia computadorizada cervical e torácica, a qual revelou controle do abscesso cervical, porém identificou áreas de consolidação assimétricas em ambos os lobos superiores (Figura 2b), como também conteúdo com densidade de líquido espesso no mediastino e no espaço pleural esquerdo, compatível com coleção purulenta. Foi novamente levado ao centro cirúrgico e submetido à videotoracoscopia esquerda para a drenagem cirúrgica de ambas as coleções, sendo confirmado o diagnóstico de empiema pleural e mediastinite bacteriana. Na cultura do material coletado no procedimento cirúrgico houve crescimento de Staphylococcus aureus.
A evolução do processo infeccioso sistêmico foi boa. O controle tomográfico no 17º dia de evolução mostrou completa remissão do quadro pleural, pulmonar e mediastinal (Figura 3), e o paciente recebeu alta hospitalar.
 Discussão
DiscussãoAs lesões laringotraqueais após intubação translaríngea ou traqueostomia secundárias à falta de controle na pressão dos balonetes são problemas relativamente comuns, sendo que parte dessas lesões pode evoluir para processos obstrutivos sintomáticos, exigindo procedimentos terapêuticos.
Os tratamentos endoscópicos e as plastias cirúrgicas podem apresentar complicações imediatas, principalmente a obstrução das vias aéreas superiores.
A formação de edema pulmonar não cardiogênico secundário a várias formas de obstrução das vias aéreas superiores tem sido observada. Shwartz, por exemplo, sinaliza uma incidência de 11% em adultos.(3)
O principal mecanismo fisiológico na formação desse edema está na geração de uma pressão intratorácica acentuadamente negativa que leva ao aumento do volume vascular pulmonar, da pressão hidrostática microvascular e da pressão transmural capilar pulmonar. A transudação a partir do espaço capilar pulmonar em direção ao interstício progride até a formação do edema pulmonar.(4)
No EPPN, também pode estar envolvido o rompimento da membrana alvéolo-capilar devido à elevação da pressão negativa intratorácica, causando aumento da permeabilidade capilar e edema pulmonar.(5) Além disso, o vigoroso esforço inspiratório de um indivíduo com grande massa muscular contra uma via aérea obstruída (manobra de Mueller),(3) como no presente relato, pode ter influência significativa no desenvolvimento do EPPN.
A insuficiência respiratória aguda libera catecolaminas, resultando em aumento no volume sanguíneo no pulmão causado pela translocação do sangue da circulação sistêmica para a circulação pulmonar. Isso se deve à elevação da pressão arterial sistêmica conseqüente à vasoconstrição causada pela oferta de aminas circulantes, assim como à elevação do retorno venoso por redução da pressão atrial direita secundária à transmissão da pressão intra-torácica negativa.(3)
Existem dois tipos de EPPN: o tipo 1, que é seguido de súbita e intensa obstrução, como laringoespasmo pós-extubação e epiglotite, e o tipo 2, que se desenvolve após a liberação cirúrgica de obstruções crônicas das vias aéreas, como tumores laríngeos, adenóides e amígdalas (adenotonsilectomia) ou bócios intratorácicos.(6-9)
No tipo 1 ocorrem predominantemente alterações no retorno venoso e no débito cardíaco as quais resultam na transudação do fluido para o espaço alveolar, enquanto no tipo 2 há perda da pressão expiratória final positiva intrínseca (PEEPi ou auto-PEEP) em razão da desobstrução da lesão.(9)
No presente relato, classificado como tipo 1, o fator obstrutivo agudo foi causado pela associação entre a órtese metálica, que reduziu a luz traqueal para cerca de 20 mm, e o abaulamento da parede posterior da traquéia, logo abaixo da órtese, decorrente da coleção purulenta cervical.
A transudação capilar de material proteináceo pode ser parte da clássica descrição de secreção rósea ou serosanguinolenta espumante no EPPN, onde as extremas elevações na pressão transmural rompem a membrana alvéolo-capilar, levando à transudação de hemáceas para os alvéolos e ocasionando franca hemorragia.(1)
A hemorragia alveolar difusa por pressão intratorácica negativa é um fenômeno extremamente raro.(3) Tem sido postulado como fator causal o dano capilar pulmonar ocorrido pela força de estiramento, seguido pela ruptura mecânica da membrana alvéolo-capilar, caracterizando a lesão alveolar difusa, fator que pode ser potencializado pelas rápidas mudanças na pressão transmural independentemente de picos pressóricos.(10)
Acreditamos que, no presente relato, a reação inflamatória desencadeada pelo processo infeccioso por meio da liberação de interleucinas pelos neutrófilos ativados, como também o aumento da permeabilidade vascular elevando o extravasamento protéico, favoreceram a infiltração tanto alveolar como intersticial do fluido, agravando o EPPN.
O EPPN caracteriza-se por apresentar rápida evolução (em minutos), com melhora nas primeiras 36 h, e resolução, com bom prognóstico, por meio da oferta suplementar de oxigênio. No entanto, 9 a 18% dos casos requerem pressão positiva contínua nas vias aéreas,(11) e 34 a 46% dos doentes necessitam de ventilação mecânica controlada por intubação orotraqueal.(12,13) Há relato de evolução fatal por síndrome da angústia respiratória aguda e falência múltipla de órgãos e sistemas após a obstrução aguda das vias aéreas.(14)
A restrição de fluídos e o uso de diurético nessa situação são controversos.(1)
O edema associado à hemorragia pulmonar é uma rara causa de lesão pulmonar aguda resultante de pressão negativa em doentes com obstrução das vias aéreas superiores. A correção dos fatores causais, o rápido diagnóstico e o tratamento adequado são necessários para evitar terapêuticas equivocadas e também complicações iatrogênicas potencialmente deletérias.(15,16)
Referências 1. Koh MS, Hsu AA, Eng P. Negative pressure pulmonary oedema in the medical intensive care unit. Intensive Care Med. 2003;29(9):1601-4.
2. Bhavani-Shankar K, Hart NS, Mushlin PS. Negative pressure induced airway and pulmonary injury. Can J Anaesth. 1997;44(1):78-81.
3. Schwartz DR, Maroo A, Malhotra A, Kesselman H. Negative pressure pulmonary hemorrhage. Chest. 1999;115(4):1194-7.
4. Van Kooy MA, Gargiulo RF. Postobstructive pulmonary edema. Am Fam Physician. 2000;62(2):401-4.
5. Pavlin DJ, Nessly ML, Cheney FW. Increased pulmonary vascular permeability as a cause of re-expansion edema in rabbits. Am Rev Respir Dis. 1981;124(4):422-7.
6. Willms D, Shure D. Pulmonary edema due to upper airway obstruction in adults. Chest. 1988;94(5):1090-2.
7. Guffin TN, Har-el G, Sanders A, Lucente FE, Nash M. Acute postobstructive pulmonary edema. Otolaryngol Head Neck Surg. 1995;112(2):235-7.
8. McGowan FX, Kenna MA, Fleming JA, O'Connor T. Adenotonsillectomy for upper airway obstruction carries increased risk in children with a history of prematurity. Pediatr Pulmonol. 1992;13(4):222-6.
9. Ikeda H, Asato R, Chin K, Kojima T, Tanaka S, Omori K, et al. Negative-pressure pulmonary edema after resection of mediastinum thyroid goiter. Acta Otolaryngol. 2006;126(8):886-8.
10. West JB, Mathieu-Costello O. Stress failure of pulmonary capillaries: role in lung and heart disease. Lancet. 1992;340(8822):762-7.
11. Rocker GM, Mackenzie MG, Williams B, Logan PM. Noninvasive positive pressure ventilation: successful outcome in patients with acute lung injury/ARDS. Chest. 1999;115(1):173-7.
12. Butterell H, Riley RH. Life-threatening pulmonary oedema secondary to tracheal compression. Anaesth Intensive Care. 2002;30(6):804-6.
13. Antonelli M, Conti G, Moro ML, Esquinas A, Gonzalez-Diaz G, Confalonieri M, et al. Predictors of failure of noninvasive positive pressure ventilation in patients with acute hypoxemic respiratory failure: a multi-center study. Intensive Care Med. 2001;27(11):1718-28.
14. Adolph MD, Oliver AM, Dejak T. Death from adult respiratory distress syndrome and multiorgan failure following acute upper airway obstruction. Ear Nose Throat J. 1994;73(5):324-7.
15. Westreich R, Sampson I, Shaari CM, Lawson W. Negative-pressure pulmonary edema after routine septorhinoplasty: discussion of pathophysiology, treatment, and prevention. Arch Facial Plast Surg. 2006;8(1):8-15.
16. Ackland GL, Mythen MG. Negative pressure pulmonary edema as an unsuspected imitator of acute lung injury/ARDS. Chest. 2005;127(5):1867-8.
____________________________________________________________________________________________________________________
Estudo realizado na Universidade Estadual de Campinas - Unicamp - Campinas (SP) Brasil.
1. Médico Assistente da Disciplina de Cirurgia Torácica. Universidade Estadual de Campinas - Unicamp - Campinas (SP) Brasil.
2. Professor e Coordenador da Disciplina de Cirurgia Torácica. Universidade Estadual de Campinas - Unicamp - Campinas (SP) Brasil.
Endereço para correspondência: Ricardo Kalaf Mussi. Rua Copaíba, 810, Jd. Miriam, CEP 13098-347, Campinas, SP, Brasil.
Tel 55 19 3521-9441. E-mail: rkalaf@fcm.unicamp.br
Recebido para publicação em 7/3/2007. Aprovado, após revisão, em 8/8/2007.




