ABSTRACT
Objective: To evaluate the use of video-assisted thoracoscopy in the surgical treatment of chylothorax developed after the surgical correction of congenital heart disease in children. Methods: We reviewed the medical charts of 3,092 children who underwent surgery for congenital heart disease between February of 2002 and February of 2007 at the Heart Institute of the University of São Paulo School of Medicine Hospital das Clínicas, in São Paulo, Brazil. Results: Of the 3,092 children, 64 (2.2%) presented with chylothorax as a postoperative complication. In 50 (78.1%) of those patients, the clinical management was successful, whereas it failed in 14 (21.9%), all of whom were then submitted to thoracic duct ligation by video-assisted thoracoscopy. The thoracic duct ligation was successful in 12 patients (86%) but failed in 2. In the postoperative period, additional clinical measures, such as a low-fat diet and parenteral nutrition, were required in order to resolve those 2 cases. There was no surgical morbidity or mortality. Of the 14 patients who underwent thoracic duct ligation, 5 (35%) died due to cardiac or infectious complications. Conclusions: Video-assisted thoracic duct ligation can be safely performed in patients with severe heart disease, and the outcomes are favorable.
Keywords:
Chylothorax; Heart defects, congenital; Thoracic duct.
RESUMO
Objetivo: Avaliar o uso de videotoracoscopia no tratamento cirúrgico do quilotórax após cirurgia para correção de cardiopatias congênitas em crianças. Métodos: Revisamos os prontuários médicos de 3.092 crianças operadas para a correção de cardiopatias congênitas no Instituto do Coração/Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo, São Paulo (SP) entre fevereiro de 2002 e fevereiro de 2007. Resultados: Das 3.092 crianças, 64 (2,2%) apresentaram quilotórax como complicação pós-operatória. Em 50 (78,1%) dessas, o tratamento clínico foi bem-sucedido, enquanto esse falhou em 14 (21,9%), as quais foram submetidas à ligação do ducto torácico por videotoracoscopia. A ligação do ducto torácico obteve sucesso em 12 pacientes (86%) e falhou em 2 casos, os quais foram resolvidos com medidas clínicas adicionais, como dieta pobre em gorduras e nutrição parenteral. Não houve morbidade ou mortalidade relacionada à operação. Dos 14 pacientes, 5 (35%) faleceram em decorrência de complicações cardíacas ou infecciosas. Conclusões: A ligadura videoassistida do ducto torácico pode ser realizada com segurança em pacientes gravemente enfermos e com doença cardíaca grave, com resultados favoráveis.
Palavras-chave:
Quilotórax; Cardiopatias congênitas; Ducto torácico.
IntroduçãoO quilotórax é definido como a presença de linfa em espaço pleural secundária a vazamento do ducto torácico ou de um de seus principais tributários. O quilotórax tem várias causas, incluindo malignidade, trauma (incluindo cirurgia) e transtornos diversos (tais como trombose venosa profunda, sarcoidose e insuficiência cardíaca congestiva), e também pode ser idiopático.(1,2)
O quilotórax pós-operatório na infância é uma complicação potencialmente grave de qualquer procedimento cirúrgico torácico. A incidência relatada de quilotórax pós-operatório após cirurgia para correção de cardiopatia congênita varia de 1,5% a 4,7%.(3-5) Associa-se a procedimentos extrapericárdicos, tais como fechamento da persistência do canal arterial, procedimento de Blalock-Taussig e correção da coarctação da aorta. Nesses casos, o quilotórax resulta de trauma direto em ducto torácico ou em seus tributários. O quilotórax também ocorre após procedimentos intrapericárdicos, tais como procedimentos de Glenn e de Foltan, sem trauma óbvio em vasos linfáticos.(6,7) Essas operações geram pressão venosa central alta, levando a pressão linfática alta e linforreia. A perda de linfa após a drenagem, às vezes em grandes quantidades, pode levar a depleção nutricional, distúrbios eletrolíticos, hipolipemia e linfocitopenia com imunodeficiência. Essas complicações são mal toleradas em lactentes pequenos com cardiopatia grave e se associam a alta mortalidade quando não tratadas.(3-8)
Os pacientes geralmente permanecem assintomáticos, apresentando derrames quilosos acentuados apenas após iniciarem uma dieta regular. O tratamento inicial consiste em drenagem pleural, permitindo expansão pulmonar, e estratégias dietéticas para diminuir a linforreia. Uma dieta pobre em gorduras com triglicerídeos de cadeia média é a abordagem inicial, seguida de jejum prolongado e nutrição parenteral, em caso de insucesso daquele em reduzir a fistula quilosa. Essa abordagem é bem-sucedida na maioria dos casos (66%-100%).(4,6-9) Entretanto, esse tratamento é dispendioso e prolongado, levando até 15 dias.
Recentemente, o octreotídeo foi introduzido nesse contexto. Foram relatados resultados positivos com o uso de dieta pobre em gorduras ou nutrição parenteral em pacientes com quilotórax persistente. O mecanismo de ação desses procedimentos é desconhecido, e são necessários estudos controlados para definir o seu papel no tratamento.(4,10-12) O tratamento cirúrgico é reservado para os poucos casos de falha do tratamento inicial conservador. O momento da cirurgia é controverso. Entretanto, na maioria dos estudos, as intervenções cirúrgicas são recomendadas quando não há resolução após 1-3 semanas de tratamento clínico ou se a drenagem diária exceder 100 mL/kg.(4,8,12-15) A ligadura do ducto torácico, realizada pela primeira vez por Lampson in 1948,(16) é uma opção de tratamento eficaz para pacientes com baixa morbidade. O uso de técnicas videoassistidas foi descrito recentemente. Quando essas técnicas são aplicadas, pode-se conseguir a ligadura do ducto torácico com menos trauma cirúrgico e menos complicações pós-operatórias.(3,8,17-20)
MétodosTrata-se de um estudo retrospectivo observacional e descritivo no qual os dados foram coletados de prontuários médicos. A população estudada incluiu pacientes tratados em nosso serviço entre fevereiro de 2002 e fevereiro de 2007. Todos haviam sido operados para a correção de cardiopatia congênita e haviam posteriormente desenvolvido quilotórax. O diagnóstico de quilotórax se baseou na detecção de uma concentração alta de triglicerídeos (> 110 mg/dL) ou uma relação triglicerídeo/colesterol > 1 no líquido pleural. A presença de quilomícrons e uma contagem de leucócitos no exame microscópico do líquido pleural também indicavam quilotórax. O algoritmo para o tratamento desses pacientes é apresentado na Figura 1. A junta institucional de revisão aprovou o estudo e, em virtude da natureza observacional do mesmo, dispensou a necessidade de termo de consentimento livre e esclarecido.
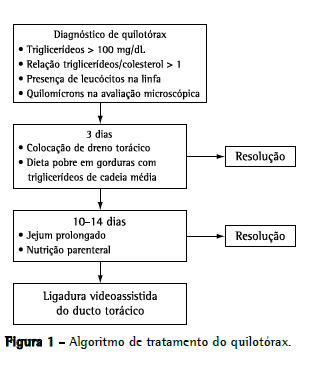
Todos os pacientes diagnosticados com quilotórax foram submetidos ao tratamento clínico. Se o tratamento clínico falhasse, realizava-se a ligadura videoassistida do ducto torácico. Os procedimentos cirúrgicos foram todos realizados pelo mesmo cirurgião, de forma padrão. Após a intubação orotraqueal, as crianças receberam azeite de oliva através de uma sonda nasogástrica (10 mL/kg) para aumentar a visualização do ducto torácico e da fístula no campo operatório. O procedimento foi realizado no lado do derrame ou no hemitórax direito quando o derrame era bilateral. Realizou-se uma minitoracotomia póstero-lateral no 5º espaço intercostal para a dissecção e a tração pulmonar. Para a visualização, introduziu-se um toracoscópio de 30° no 8º espaço intercostal no meio da linha axilar. O ducto torácico foi dissecado entre o esôfago e a coluna torácica e ligado com uma linha de sutura dupla reforçada com pledgets de teflon, e um dreno torácico foi mantido no acesso toracoscópico (Figura 2). Considerando-se que, além da ligadura do ducto, podem existir variações anatômicas significativas em relação ao padrão normal, incluindo ductos acessórios, a gordura entre o esôfago e a coluna foi ligada. No 1º dia pós-operatório, iniciou-se uma dieta regular, a qual foi então mantida na medida do possível. O dreno torácico foi retirado quando o débito diário caiu para < 10 mL/kg, supondo que não houvesse sinais de recorrência do quilotórax. Foram revisados os dados médicos de todos os pacientes operados. Os dados coletados incluíam características demográficas, cardiopatia, cirurgia cardíaca realizada, duração do quilotórax, tratamento clínico e recuperação após a ligadura do ducto torácico.
 Resultados
ResultadosEntre fevereiro de 2002 e fevereiro de 2007, 3.092 pacientes foram operados para a correção de cardiopatias congênitas em nosso serviço. Desses, 64 (2,2%) apresentaram quilotórax como complicação. Em 50 (78,1%) desses pacientes, o tratamento clínico foi bem sucedido, enquanto esse falhou em 14 (22,1%), os quais foram, portanto, submetidos a ligadura videoassistida do ducto torácico. Em todos esses pacientes, o dreno torácico foi mantido do dia do diagnóstico de quilotórax até o dia da cirurgia.
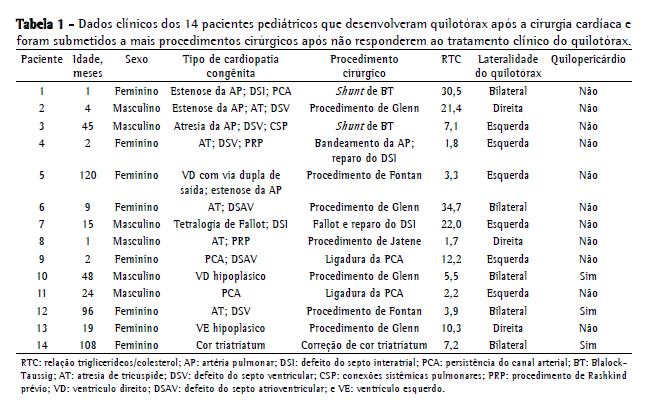
As Tabelas 1 e 2 mostram os dados referentes aos 14 pacientes submetidos a ligadura do ducto torácico. Havia 8 meninas (57%) e 6 meninos (43%), e, entre esses pacientes, a idade média ao diagnóstico de quilotórax foi de 2,3 anos (variação, 1 mês-10 anos). O tempo médio decorrido entre o momento da cirurgia cardíaca e o diagnóstico de quilotórax foi de 13,5 ± 11,9 dias (variação, 1-42 dias). Observou-se a presença de hipertensão venosa central em 12 pacientes (85,7%; não presente nos pacientes 9 e 11). A duração média do tratamento conservador antes da ligadura do ducto torácico foi de 39,5 ± 19,6 dias (variação, 15-79 dias). Na maioria dos casos, a cirurgia foi adiada em razão de instabilidade clínica (problemas cardíacos ou sépticos). Antes da operação, os pacientes 4, 7 e 13 receberam octreotídeo, sem qualquer redução da linforreia em nenhum dos três. Os pacientes com quilopericárdio foram abordados por meio de pericardiocentese ou videopericardioscopia e drenagem quando havia sinais de tamponamento cardíaco, e todos esses pacientes tiveram boa evolução. Nos pacientes 1 e 4, utilizou-se pleurodese associada a abrasão pleural. Nos pacientes 12 e 14, realizou-se decorticação em razão de encarceramento pulmonar.
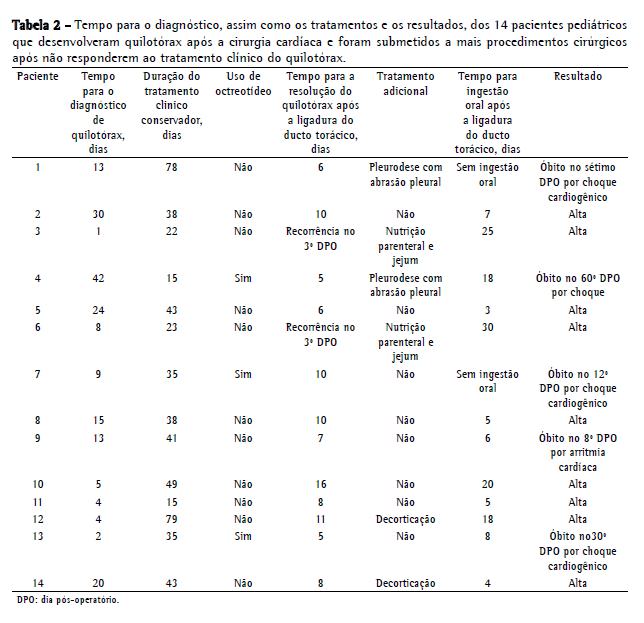
Não houve intercorrências cirúrgicas. Após a cirurgia, o dreno torácico foi retirado em um tempo médio de 9,5 dias (variação, 5-16 dias), exceto em 2 pacientes (14,2%), ambos os quais apresentaram recorrência do quilotórax. A recorrência foi diagnosticada no 3º dia pós-operatório em ambos os pacientes, e eles foram tratados com nutrição parenteral adicional e jejum por 25 dias (paciente 3) e 30 dias (paciente 6), resultando em resolução em ambos os casos. Dos 14 pacientes submetidos a ligadura do ducto torácico, 5 (35,0%) faleceram durante a internação. Nenhum óbito foi atribuído à cirurgia. Nesses 5 pacientes, não havia sinal de recorrência do quilotórax. A causa mais comum de óbito foi insuficiência cardíaca com choque cardiogênico (pacientes 1, 7 e 13). O paciente 4 faleceu por pneumonia complicada por choque séptico, e o paciente 9 teve taquiarritmia ventricular com evolução para fibrilação ventricular.
DiscussãoO quilotórax geralmente se desenvolve 1-4 semanas após a cirurgia cardíaca, quando o dreno torácico já foi retirado e o paciente encontra-se em dieta regular.(6,8,21) Dos nossos pacientes, apenas 4 desenvolveram quilotórax na primeira semana pós-operatória. Um desses 4 pacientes foi submetido ao procedimento de Fontan, e 1 foi submetido a anastomose cavopulmonar bidirecional (operação de Glenn) acompanhada por pressão venosa muito alta. Os outros 2 apresentaram quilotórax resultante de trauma direto em ducto torácico após ligadura da persistência do canal arterial e shunt de Blalock-Taussig, respectivamente. Todos eles apresentaram dispneia e derrame unilateral/bilateral, às vezes com quilopericárdio.
Nos pacientes com quilotórax, a toracocentese mostra líquido leitoso, e os resultados dos exames laboratoriais são frequentemente diagnósticos. O quilotórax ocasionalmente é complicado por adesão pleural ou espessamento pleural, e o consequente embaraço respiratório pode ser resolvido por meio da inserção de um dreno torácico, resultando em expansão pulmonar.(3,6-8) Dois pacientes desenvolveram espessamento pleural e encarceramento pulmonar, principalmente por causa da drenagem prolongada (43 e 79 dias, respectivamente). Deve-se ter em mente que o líquido quiloso é bacteriostático, rico em linfócitos e imunoglobulinas, e o empiema secundário é, portanto, incomum nesses casos.(22) Apesar dos longos períodos de tratamento clínico em nosso estudo, nenhum dos pacientes desenvolveu infecção pleural.
No quilotórax, a tarefa mais difícil é o fechamento da fístula linfática por lesão do ducto torácico. Uma dieta pobre em gorduras é utilizada para reduzir o fluxo linfático, reduzindo assim o débito da fístula.(3-8) É também comum se prescrever a administração oral de triglicerídeos de cadeia média, porque eles entram diretamente no sistema venoso do intestino delgado, e não no fluxo linfático esplâncnico.(3-8) A nutrição parenteral total é frequentemente utilizada quando uma dieta pobre em gorduras falha em reduzir o vazamento. Quanto tempo a nutrição parenteral deve ser utilizada antes de se adotar uma abordagem mais agressiva é motivo de debate.(3,4,8,9,23) Períodos prolongados de nutrição parenteral têm inúmeras complicações, tais como colestase, infecção de linha central e trombose venosa.(24-26) Complicações posteriores podem, por sua vez, aumentar ainda mais o quilotórax. Há relatos de quilotórax causado por trombose venosa secundária a inserção da linha central, quando nenhum outro procedimento havia sido realizado.(27,28)
Pacientes pediátricos com quilotórax podem apresentar fístulas de alto débito persistentes, apesar da nutrição parenteral e do jejum, alguns pacientes até mesmo apresentando perdas diárias > 200 mL/kg. O tratamento dos distúrbios de fluidos e eletrólitos nesses pequenos lactentes com tais perdas é bastante difícil.(3-8,23) A somastotina e seu análogo, o octreotídeo, têm sido utilizados nesses casos, e alguns relatos na literatura mostram resultados favoráveis, com resolução do quilotórax.(4,10-12) No presente estudo, o octreotídeo foi utilizado em conjunto com a nutrição parenteral em 3 pacientes, sem sucesso. É importante ressaltar que todos os três pacientes faleceram durante a internação. Consideramos o octreotídeo um tratamento clínico adjuvante, mas não a resposta definitiva para o tratamento do quilotórax.
A pressão venosa central alta e a trombose venosa são reconhecidos fatores associados ao quilotórax refratário.(6,7) Em um modelo experimental em cães, o quilotórax foi induzido por meio de ligadura da veia cava superior, embora o quilotórax tenha sido evitado se o ducto torácico tivesse sido previamente ligado.(29) Os pacientes submetidos a anastomose cavopulmonar têm um risco aumentado de quilotórax, e alguns apresentam débito alto e não respondem ao tratamento clínico.(4,6,7) No presente estudo, 85,7% dos pacientes tiveram pressão venosa alta, e 42,8% foram submetidos a anastomose cavopulmonar.
Acreditamos que esses pacientes deveriam ter recebido tratamento mais agressivo para evitar longos períodos de nutrição parenteral e drenagem pleural sem sucesso.
O tratamento cirúrgico é indicado quando o tratamento clínico falha, o que frequentemente não é detectado até 2-3 semanas depois.(4,6-9) Várias técnicas cirúrgicas têm sido empregadas, tais como pleurodese com abrasão pleural (ou com pleurectomia), shunt pleuroperitoneal, shunt entre a cavidade pleural e a veia subclávia, anastomose entre o ducto torácico e a veia ázigos e ligadura do ducto torácico, sendo a última a mais frequentemente realizada.(4,8,12 15) A técnica de ligadura do ducto torácico tem duas variantes. A ligadura em massa do ducto torácico é realizada sem a dissecção individual do ducto torácico, e todo o tecido da aorta, coluna torácica, esôfago e veia ázigo é ligado em massa. Em outra variante, o ducto torácico é identificado e individualmente ligado (Figura 2).
O uso de uma sonda nasogástrica é de vital importância para a identificação do esôfago, e a introdução de óleo de oliva facilita a localização da fístula e do ducto torácico. A operação pode ser realizada no lado direito ou esquerdo, embora a escolha do lado em que há derrame permite melhor limpeza pleural e expansão pulmonar. Em alguns pacientes, é ainda necessário realizar decorticação pleural, como no caso de nossos 2 pacientes com encarceramento pulmonar. Em nosso serviço, se o derrame for bilateral, operamos através do lado direito porque isso propicia uma melhor visualização do ducto torácico. No lado esquerdo, a presença da aorta descendente torna a dissecção do ducto torácico mais difícil.
No passado, a ligadura do ducto torácico era conseguida por meio de toracotomia póstero-lateral clássica. Em virtude do uso crescente de técnicas minimamente invasivas, a abordagem videoassistida se tornou o método de escolha. Vários relatos mostram a eficácia da videotoracoscopia para ligadura do ducto torácico.(3,8,17-19,23) No presente estudo, utilizamos uma minitoracotomia (4-5 cm), uma vez que a ventilação monopulmonar não é possível em lactentes com doenças cianóticas e baixo peso corporal (≤ 4 kg em alguns dos lactentes avaliados aqui). Essa abordagem, com trauma mínimo, permite um melhor curso pós-operatório, com menos dor e melhor função pulmonar. Duas crianças foram submetidas a pleurodese como tratamento adjuvante para ligadura do ducto torácico. A pleurodese é uma forma de se obter adesão pleural, obliterando, assim, o vazamento de líquido quiloso. Entretanto, percebemos que esse procedimento poderia ser eliminado porque não acrescentava nenhuma vantagem em relação à ligadura de um só ducto. Devido à fragilidade da parede do ducto torácico, assim como para evitar a fístula quilosa, preferiu-se uma linha de sutura dupla reforçada com pledgets de teflon.
A embolização percutânea do ducto torácico representa uma modalidade terapêutica adicional e uma alternativa viável à cirurgia aberta, mostrando resultados efetivos em adultos. Entretanto, em vista do sucesso da ligadura do ducto torácico em crianças, não está claro quais vantagens a embolização percutânea do ducto torácico pode oferecer em populações pediátricas.
Em nosso serviço, utilizamos um algoritmo de tratamento, conforme mostrado na Figura 1. Na maioria dos pacientes (78,1%), o quilotórax foi resolvido por meio da inserção de dreno torácico e mudanças dietéticas, mostrando a eficácia dessa abordagem. Entretanto, os outros 21,9% não melhoraram com as mudanças dietéticas, e realizou-se então a ligadura videoassistida do ducto torácico. Nossa estratégia recomendada foi submeter os pacientes a tratamento clínico por 2-3 semanas antes de se optar pelo tratamento cirúrgico. Porém, em virtude do perfil clínico dos pacientes, a cirurgia foi frequentemente adiada para que o estado geral dos mesmos pudesse melhorar primeiro. Em 12 pacientes (85,7%), o quilotórax foi resolvido, e houve apenas duas falhas. Nossos pacientes representavam um grupo de pacientes graves, e todas as outras formas de tratamento para quilotórax foram utilizadas. Embora houvesse pacientes com pressão venosa alta e outros com anastomose cavopulmonar, conseguimos resultados positivos nessas situações. As duas falhas observadas em nosso serviço foram resolvidas com nutrição parenteral adicional, e os pacientes receberam alta após a resolução do quilotórax. As variações das vias linfáticas e a presença de canais linfáticos acessórios ou pequenos no mediastino, assim como o fato de que não é possível determinar a causa do quilotórax com base em dados clínicos,(30) podem explicar a falha do procedimento de ligadura do ducto torácico.
No presente estudo, a maioria dos óbitos ocorridos após a ligadura do ducto torácico estava relacionada a complicações cardíacas, a mortalidade pós-operatória geral sendo de 35,7%. Supomos que o quilotórax e sua gravidade estejam ligados ao prognóstico geral. Os defeitos cardíacos congênitos graves e as operações cardíacas complexas predispõem a quilotórax refratário. Em nosso estudo, a taxa de mortalidade pode ter meramente refletido o prognóstico dessas cardiopatias. É necessária uma melhor estratégia para o tratamento desses pacientes. Uma abordagem multidisciplinar, envolvendo o cirurgião torácico, o cardiologista pediátrico e o nutricionista, é importante para definir um melhor plano de tratamento e determinar o momento apropriado para a intervenção cirúrgica.
O quilotórax é uma complicação incomum, mas preocupante, da cirurgia cardíaca pediátrica. O tratamento clínico das fistulas quilosas é frequentemente associado à depleção nutricional e eletrolítica, assim como ao prolongamento do período de tratamento. Pacientes de cirurgia cardíaca pediátrica com quilotórax representam um subgrupo de pacientes gravemente enfermos e com cardiopatia grave. Entretanto, a ligadura videoassistida do ducto torácico pode produzir resultados favoráveis. A videotoracoscopia é uma abordagem cirúrgica que oferece a vantagem de acesso a todo o hemitórax, com excelente visualização das estruturas mediastinais. A taxa de mortalidade encontrada no presente estudo refletiu a gravidade da cardiopatia nesses pacientes. A intervenção cirúrgica precoce pode evitar períodos prolongados de fome nesse grupo, melhorando assim os resultados e aumentando a sobrevida.
Referências1. Torrejais JC, Rau CB, de Barros JA, Torrejais MM.
Spontaneous chylothorax associated with light physical activity. J Bras Pneumol. 2006;32(6):599-602.
2. Vaz MA, Pego-Fernandes P. Quilotórax. J Bras Pneumol. 2006;32(Suppl 4):S197-S203.
3. Nguyen DM, Shum-Tim D, Dobell AR, Tchervenkov CI. The management of chylothorax/chylopericardium following pediatric cardiac surgery: a 10-year experience. J Card Surg. 1995;10(4 Pt 1):302-8.
4. Chan EH, Russell JL, Williams WG, Van Arsdell GS, Coles JG, McCrindle BW. Postoperative chylothorax after cardiothoracic surgery in children. Ann Thorac Surg. 2005;80(5):1864-70.
5. Cormack BE, Wilson NJ, Finucane K, West TM. Use of
Monogen for pediatric postoperative chylothorax. Ann Thorac Surg. 2004;77(1):301-5.
6. Bond SJ, Guzzetta PC, Snyder ML, Randolph JG. Management of pediatric postoperative chylothorax. Ann Thorac Surg. 1993;56(3):469-72; discussion 472-3.
7. Beghetti M, La Scala G, Belli D, Bugmann P, Kalangos A, Le Coultre C. Etiology and management of pediatric chylothorax. J Pediatr. 2000;136(5):653-8.
8. Fahimi H, Casselman FP, Mariani MA, van Boven WJ, Knaepen PJ, van Swieten HA. Current management of postoperative chylothorax. Ann Thorac Surg. 2001;71(2):448-50; discussion 450-1.
9. Cerfolio RJ, Allen MS, Deschamps C, Trastek VF, Pairolero PC. Postoperative chylothorax. J Thorac Cardiovasc Surg. 1996;112(5):1361-5; discussion 1365-6.
10. Landvoigt MT, Mullett CJ. Octreotide efficacy in the treatment of chylothoraces following cardiac surgery in infants and children. Pediatr Crit Care Med. 2006;7(3):245-8.
11. Barili F, Polvani G, Topkara VK, Dainese L, Roberto M, Aljaber E, et al. Administration of octreotide for management of postoperative high-flow chylothorax. Ann Vasc Surg. 2007;21(1):90-2.
12. Chan SY, Lau W, Wong WH, Cheng LC, Chau AK, Cheung YF. Chylothorax in children after congenital heart surgery. Ann Thorac Surg. 2006;82(5):1650-6.
13. Liu CS, Tsai HL, Chin TW, Wei CF. Surgical treatment of chylothorax caused by cardiothoracic surgery in children. J Chin Med Assoc. 2005;68(5):234-6.
14. Pêgo-Fernandes PM, Jatene FB, Tokunaga CC, Simão DT, Beirutty R, Iwahashi ER, et al. Ligation of the thoracic duct for the treatment of chylothorax in heart diseases. Arq Bras Cardiol. 2003;81(3):309-17.
15. Selle JG, Snyder WH 3rd, Schreiber JT. Chylothorax: indications for surgery. Ann Surg. 1973;177(2):245-9.
16. Lampson RS. Traumatic chylothorax; a review of the literature and report of a case treated by mediastinal ligation of the thoracic duct. J Thorac Surg. 1948;17(6):778-91.
17. Christodoulou M, Ris HB, Pezzetta E. Video-assisted right supradiaphragmatic thoracic duct ligation for non-traumatic recurrent chylothorax. Eur J Cardiothorac Surg. 2006;29(5):810-4.
18. Aerts NR, Erling N Jr, Fontes PR. Thoracoscopic thoracic duct ligation for chylothorax after traumatic subclavian artery injury. J Thorac Cardiovasc Surg. 2006;131(3):752-3.
19. Buchan KG, Hosseinpour AR, Ritchie AJ. Thoracoscopic thoracic duct ligation for traumatic chylothorax. Ann Thorac Surg. 2001;72(4):1366-7.
20. Wurnig PN, Hollaus PH, Ohtsuka T, Flege JB, Wolf RK. Thoracoscopic direct clipping of the thoracic duct for chylopericardium and chylothorax. Ann Thorac Surg. 2000;70(5):1662-5.
21. Hughes RL, Mintzer RA, Hidvegi DF, Freinkel RK, Cugell DW. The management of chylothorax. Clinical conference in pulmonary disease from Northwestern University Medical School, Chicago. Chest. 1979;76(2):212-8.
22. Natrajan S, Hadeli O, Quan SF. Infected spontaneous chylothorax. Diagn Microbiol Infect Dis. 1998;30(1):31-2.
23. Büttiker V, Fanconi S, Burger R. Chylothorax in children: guidelines for diagnosis and management. Chest. 1999;116(3):682-7.
24. Carter BA, Shulman RJ. Mechanisms of disease: update on the molecular etiology and fundamentals of parenteral nutrition associated cholestasis. Nat Clin Pract Gastroenterol Hepatol. 2007;4(5):277-87.
25. Marra AR, Opilla M, Edmond MB, Kirby DF. Epidemiology of bloodstream infections in patients receiving long-term total parenteral nutrition. J Clin Gastroenterol. 2007;41(1):19-28.
26. Johnson T, Sexton E. Managing children and adolescents on parenteral nutrition: Challenges for the nutritional support team. Proc Nutr Soc. 2006;65(3):217-21.
27. Thomas R, Christopher DJ, Roy A, Rose A, Chandy ST, Cherian RA, et al. Chylothorax following innominate vein thrombosis--a rare complication of transvenous pacemaker implantation. Respiration. 2007;74(3):338-40.
28. Manghat N, Hancock J, Walsh M, Puckett M, Noble R, Travis S. Thrombolysis for central venous occlusion causing bilateral chylothorax in a patient with down syndrome. J Vasc Interv Radiol. 2004;15(5):511-5.
29. Blalock A, Cunningham RS, Robinson CS. Experimental production of chylothorax by occlusion of the superior vena cava. Ann Surg. 1936;104(3):359-64.
30. Milonakis M, Chatzis AC, Giannopoulos NM, Contrafouris C, Bobos D, Kirvassilis GV, et al. Etiology and management of chylothorax following pediatric heart surgery. J Card Surg. 2009;24(4):369-73.
* Trabalho realizado no Instituto do Coração, Hospital das Clínicas, Faculdade de Medicina da Universidade de São Paulo, São Paulo (SP) Brasil.
Endereço para correspondência: Paulo Manuel Pêgo Fernandes. Instituto do Coração, Serviço de Cirurgia Torácica, Avenida Dr. Enéas de Carvalho Aguiar, 44, Bloco II, 2º andar, Sala 9, CEP 05403-000, São Paulo, SP, Brasil.
Tel 55 11 3069-5248. E-mail: paulo.fernandes@incor.usp.br
Apoio financeiro: Nenhum.
Recebido para publicação em 23/2/2010. Aprovado, após revisão, em 21/9/2010.
Sobre os autoresPaulo Manuel Pego-Fernandes
Professor Associado. Departamento de Cardiopneumologia, Faculdade de Medicina da Universidade de São Paulo, São Paulo (SP) Brasil.
Mauro Boldrini Nascimbem
Médico Residente em Cirurgia Torácica. Faculdade de Medicina da Universidade de São Paulo, São Paulo (SP) Brasil.
Otávio T. Ranzani
Médico Residente. Faculdade de Medicina da Universidade de São Paulo, São Paulo (SP) Brasil.
Mônica Satsuki Shimoda
Médica Assistente. Divisão de Cardiologia, Instituto do Coração, Hospital das Clínicas, Faculdade de Medicina da Universidade de São Paulo, São Paulo (SP) Brasil.
Rosângela Monteiro
Biologista Chefe. Disciplina de Cirurgia Torácica, Hospital das Clínicas, Faculdade de Medicina da Universidade de São Paulo, São Paulo (SP) Brasil.
Fábio Biscegli Jatene
Professor Titular. Disciplina de Cirurgia Torácica, Faculdade de Medicina da Universidade de São Paulo, São Paulo (SP) Brasil.





