ABSTRACT
Objective: To evaluate the pattern of pro-inflammatory cytokines, anti-inflammatory cytokines and the acute phase response (APR) as markers of the response to treatment of pulmonary tuberculosis. Methods: Twenty-eight patients with pulmonary tuberculosis were evaluated at three time points: pretreatment (T0), treatment month 3 (T3) and treatment month 6 (T6). Levels of interferon-gamma (IFN-γ), tumor necrosis factor-alpha (TNF-α), interleukine-10 (IL-10) and transforming growth factor-beta (TGF-β) were determined using ELISA in the supernatant of peripheral blood mononuclear cell and monocyte culture. Levels of total protein, albumin, globulins, C-reactive protein (CRP), alpha-1-acid glycoprotein (AAG) and erythrocyte sedimentation rate (ESR) were also determined. All of these parameters were also evaluated, only once, in a group of healthy controls. Results: In relation to controls, patients presented cytokine levels and APR that were higher at T0, lower at T3 and either lower (TNF-α, IL-10, TGF-β, AAG and ESR) or normal (IFN-γ and CRP) at T6. Conclusions: For individuals with negative smear sputum microscopy, CRP, AAG and ESR are potential markers of pulmonary tuberculosis and of the need for treatment; CRP (T0 > T3 > T6 = reference) can also be a marker of treatment response. In the patients, the Th0 profile (IFN-γ, IL-10, TNF-α and TGF-β), inducer of and protector against inflammation, predominated at T0, whereas the Th2 profile (IL-10, TNF-α and TGF-β), protecting against the harmful pro-inflammatory effect of the remaining TNF-α, predominated at T6. The behavior of IFN-γ (T0 > T3 > T6 = controls) suggests its use as a marker of treatment response.
Keywords:
Acute-phase proteins; Cytokines; Mycobacterium tuberculosis; Tuberculosis/therapy.
RESUMO
Objetivo: Analisar o padrão de citocinas pró- e antiinflamatórias e da resposta de fase aguda (RFA) como marcadores de resposta ao tratamento da tuberculose pulmonar. Métodos: Determinação dos níveis de interferon-gama (IFN-γ), tumor necrosis factor-alpha (TNF-α, fator de necrose tumoral-alfa), interleucina-10 (IL-10) e transforming growth factor-beta (TGF-β, fator transformador de crescimento-beta), pelo método ELISA, em sobrenadante de cultura de células mononucleares do sangue periférico e monócitos, assim como dos níveis de proteínas totais, albumina, globulinas, alfa-1-glicoproteína ácida (AGA), proteína C reativa (PCR) e velocidade de hemossedimentação (VHS) em 28 doentes com tuberculose pulmonar, em três tempos: antes (T0), aos três meses (T3) e aos seis meses (T6) de tratamento, em relação aos controles saudáveis, em um único tempo. Resultados: Os pacientes apresentaram valores maiores de citocinas e RFA que os controles em T0, com diminuição em T3 e diminuição (TNF-α, IL-10, TGF-β, AGA e VHS) ou normalização (IFN-γ e PCR) em T6. Conclusões: PCR, AGA e VHS são possíveis marcadores para auxiliar no diagnóstico de tuberculose pulmonar e na indicação de tratamento de indivíduos com baciloscopia negativa; PCR (T0 > T3 > T6 = referência) pode também ser marcador de resposta ao tratamento. Antes do tratamento, o perfil Th0 (IFN-γ, IL-10, TNF-α e TGF-β), indutor de e protetor contra inflamação, prevaleceu nos pacientes; em T6, prevaleceu o perfil Th2 (IL-10, TNF-α e TGF-β), protetor contra efeito nocivo pró-inflamatório do TNF-α ainda presente. O comportamento do IFN-γ (T0 > T3 > T6 = controle) sugere sua utilização como marcador de resposta ao tratamento.
Palavras-chave:
Proteínas da fase aguda; Citocinas; Mycobacterium tuberculosis; Tuberculose/terapia.
IntroduçãoNa infecção pelo Mycobacterium tuberculosis, a interação das células T com os macrófagos infectados é fator central da imunidade protetora contra o bacilo, e as citocinas produzidas por estas células são mediadores importantes que regulam a resposta imunológica e inflamatória.(1)
Após sofrerem fagocitose, os bacilos induzem macrófagos, células dendríticas e células T a secretarem o tumor necrosis factor-alpha (TNF-α, fator de necrose tumoral alfa), citocina importante para o controle da infecção ativa por seu papel na inflamação local e na ativação de macrófagos, sendo também um importante fator na imunopatologia da doença.(1,2) O interferon-gama (IFN-γ) ativa os macrófagos, que passam a produzir intermediários reativos de nitrogênio e oxigênio, que inibem o crescimento e promovem a morte da micobactéria.(1) No entanto, o bacilo sobrevive, multiplica-se no macrófago e induz o recrutamento de linfócitos T, grandes produtores de IFN-γ e TNF-α, para a formação do granuloma no foco da infecção.(1)
Quando a tuberculose está em atividade, observa-se diminuição da resposta Th1 e aumento de produção e ação de citocinas supressoras de perfil Th2, como a interleucina (IL)-10, que inibe a proliferação das células e a produção de IFN-γ, comprometendo os mecanismos microbicidas dos macrófagos e a apresentação de antígenos, além de ter efeito oposto ao do TNF-α, protegendo contra danos teciduais, pela regulação da inflamação e da apoptose. A produção dessas citocinas pelos macrófagos é estimulada por componentes da parede celular micobacteriana.(3)
Outra citocina produzida pelo macrófago, o transforming growth factor-beta (TGF-β, fator transformador de crescimento beta), suprime o perfil Th1 e participa na indução da fibrose.(4) Em baixas concentrações, atua como um fator quimiotático para monócitos e induz a secreção de IL-1α e TNF-α.(5) Na fase crônica da tuberculose, sua produção é máxima, promovendo desativação de macrófagos, inibição da expressão e funcionamento de receptores para IFN-γ.(6,7)
As citocinas pró-inflamatórias promovem o desaparecimento da micobactéria, sendo úteis como marcadores de atividade do processo inflamatório e da resposta ao tratamento. Além disso, são indutoras da resposta de fase aguda (RFA), correspondente sistêmico da inflamação, verificando-se aumento da síntese hepática e dos níveis séricos das proteínas de fase aguda, que são úteis na fase de diagnóstico e na monitorização da evolução dos pacientes, já que podem ser quantificadas de maneira seriada.(8)
Alguns marcadores são a proteína C reativa (PCR), considerada o marcador mais sensível e específico da RFA, já que sua concentração no plasma reflete diretamente a intensidade do processo patológico, e a velocidade de hemossedimentação (VHS), teste inespecífico que se altera durante o processo infeccioso e traduz a intensidade da inflamação e a resposta ao tratamento, sendo útil para monitorizar a progressão de doenças inflamatórias, como a tuberculose.(9,10)
A indução da RFA é um reflexo da ação das citocinas inflamatórias e a alteração dos níveis dos seus marcadores no sangue periférico, juntamente com dados clínico-epidemiológicos e de imagem, é indicativa de doença em atividade, mesmo com baciloscopia negativa. Esse conjunto de evidências torna a indicação do teste terapêutico mais segura, além de permitir que se verifique a ação do tratamento antituberculose. No Brasil, 26,7% dos pacientes são tratados sem confirmação diagnóstica de tuberculose pulmonar (TBP), com base apenas no quadro clínico-radiológico e na alteração dos marcadores de RFA, característicos dos processos granulomatosos.(11)
O objetivo deste trabalho foi avaliar a ação do tratamento no processo
inflamatório tuberculoso em pacientes com TBP por meio da determinação das proteínas totais, albumina, globulinas, alfa-1-glicoproteína ácida (AGA), PCR, VHS, parâmetros séricos e níveis das citocinas TNF-α, IFN-γ, IL-10 e TGF-β em sobrenadante peripheral blood mononuclear cells (PBMCs, células mononucleares do sangue periférico) e monócitos. Essas determinações foram realizadas em três momentos: antes do início (T0), aos três meses (T3) e ao final da utilização da terapêutica (T6).
MétodosO presente estudo foi aprovado pelo Comitê de Ética em Pesquisa da Faculdade de Medicina de Botucatu, Universidade Estadual Paulista (protocolo 1825/2005).
Grupos estudadosComo controles, foram estudados 20 indivíduos doadores de sangue do Hemocentro do Hospital das Clínicas da Faculdade de Medicina de Botucatu (HC-FMB) da Universidade Estadual Paulista, com média etária de 38,5 anos (variação, 24-56 anos), todos do sexo masculino. Estes foram avaliados apenas uma vez, para estabelecer o padrão de normalidade das citocinas estudadas.
Foram avaliados 28 doentes com TBP, 13 do HC-FMB e 15 do Serviço de Moléstias Infecciosas da Secretaria de Estado da Saúde de Bauru. Desses, 23 eram do sexo masculino, com média etária de 54,3 anos (variação, 21-77 anos) e 5 do feminino, com média etária de 43,4 anos (variação, 29-74 anos).
A adesão ao estudo se deu no momento do diagnóstico e após avaliação por parâmetros clínicos, determinação dos marcadores de RFA e exames de imagem. Todos foram classificados como tendo a doença de intensidade moderada. Os critérios de inclusão no estudo foram idade mínima de 18 anos e diagnóstico de TBP comprovado por baciloscopia ou cultura positivas para M. tuberculosis ou diagnóstico presuntivo em doentes com quadro clínico-epidemiológico, exames bioquímicos, hematológico e de imagem compatíveis com tuberculose em atividade e baciloscopia negativa. Foram excluídos todos os pacientes que também apresentavam outra doença granulomatosa em atividade ou HIV/AIDS. Todas as variáveis estudadas nos doentes foram determinadas em três tempos: antes do início (T0), aos três (T3) e aos seis meses (T6) do tratamento antituberculose.
Todos os doentes com TBP receberam tratamento durante seis meses e foram considerados clinicamente curados ao seu término.
Cultura de célulasForam coletados 20 mL de sangue periférico dos controles, em apenas um tempo, e dos doentes, nos três tempos do estudo. As PBMCs foram obtidas por meio da separação em gradiente de Histopaque®.(12) O anel rico em linfócitos e monócitos foi lavado com meio de cultura RPMI 1640 (Gibco Laboratories, Grand Island, NY, EUA) por 5 min a 200 rpm. Após este período, a suspensão celular foi ressuspensa em meio de cultura RPMI 1640 suplementado com 2 mM de L-glutamina (Sigma-Aldrich, St. Louis, MO, EUA), 40 µg/mL de gentamicina e 10% de soro autólogo humano inativado (meio de cultura de células completo) sendo a identificação e viabilidade das mesmas realizadas por contagem após coloração com líquido de Turk para PBMCs e com vermelho neutro para monócitos. A seguir, a suspensão celular foi distribuída em placas de cultura de 24 poços (Nunc, Life Tech Inc, Maryland, MA, EUA), com 1 × 106/mL. A cultura de PBMCs foi incubada na presença ou não de estímulo. Para isolamento de monócitos, após 1 h de incubação a 37°C em tensão de 5% de CO2, as células não-aderentes foram eliminadas através de lavagem das placas com meio de cultura RPMI 1640. Após aderência, as células foram novamente incubadas no meio de cultura de células completo na presença ou não de estímulos.
Quantificação de citocinasAs dosagens das citocinas TNF-α, IFN-γ, TGF-β e IL-10 foram realizadas com kits comerciais (R & D Systems, Billings, MT, EUA) pela técnica de ELISA, com limite de detecção para cada citocina de 5 pg/mL, no sobrenadante obtido das culturas de PBMC e monócitos, após 24 h de incubação a 37 °C, em tensão de 5% de CO2, na ausência ou presença de 8 μg/mL de fitohemaglutinina (Murex Biotech Ltd., Dartford, Kent, Reino Unido) ou 20 μg/mL de lipopolissacarídeo (Escherichia coli serotype O55:B5; Sigma-Aldrich Chemie BV, Zwijndrecht, Países Baixos), respectivamente. As alíquotas desse material foram conservadas a −80 °C até o momento da dosagem das citocinas.
Análise estatísticaOs resultados da RFA foram analisados por ANOVA, teste de Friedman, de Bonferroni, de Shapiro-Wilk, t de Student e pós-teste de Dunn. Os resultados das citocinas foram analisados por ANOVA, teste de Bonferroni e t de Student. A relação linear entre RFA e citocinas em cada momento foi estudada por meio das correlações de Spearman e de Pearson. Todos os testes foram aplicados com nível de significância α = 0,05.(13)
ResultadosOs marcadores inflamatórios de fase aguda foram avaliados em três tempos nos doentes. Em T0, os seguintes marcadores encontravam-se acima dos valores de referência (ref.) no soro de 21 dos 28 doentes, todos expressos em média e desvio-padrão: globulinas (g/dL): 3,92 ± 0,72 (ref., 2,8-3,2; IC95%: 3,59-4,25); AGA (mg/dL) nas mulheres: 127,8 ± 92,78 (ref., 40-120; IC95%: 12,87-242,73); VHS (mm/h) nas mulheres: 65 ± 31,23 (ref., ≤ 20; IC95%: 26,31-103,69), e nos homens: 37,6 ± 28,61 (ref., ≤ 10; IC95%: 18,49-56,79). As proteínas totais, albumina e AGA (homens) não diferiram do padrão de normalidade nos doentes (dados não mostrados). Com relação à PCR, 22 (81,48%) dos 27 doentes avaliados em T0 tinham valores acima dos ref. (≤ 1,00 g/dL). Os níveis de todos os marcadores sofreram decréscimo ao longo do tratamento, mas somente nos níveis de PCR (g/dL), em 20 dos 28 doentes, este decréscimo foi significante entre os três tempos (expressos em mediana e quartis): T0: 3,65 (1,70; 6,60) > T3: 0,95 (0,30; 1,60) > T6: 0,15 (0,00; 0,40) (ρ < 0,0001) (Tabela 1).

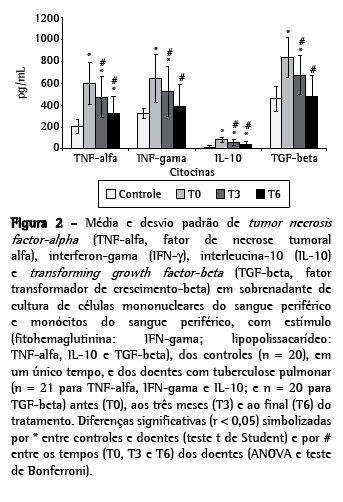
A produção de citocinas em sobrenadante de cultura de PBMCs e monócitos foi determinada em um único tempo nos controles e em três tempos nos doentes. Dos 28 doentes, 21 foram avaliados em T0, T3 e T6; e sete em T0 e T3. Os valores das citocinas a seguir estão apresentados em média e desvio padrão, sem e com estímulo, respectivamente: nos doentes, os níveis de TNF-α (pg/mL): T0 (485,30 ± 16,80; 601,90 ± 193,10) > T3 (343,20 ± 38,00; 472,40 ± 190,10) > T6 (219,30 ± 113,00; 321,40 ± 158,90) (ρ < 0,01), mas todos acima dos obtidos nos controles (125,45 ± 33,04; 204,20 ± 64,60) (p < 0,02). Os níveis de IFN-γ (pg/mL): T0 (532,20 ± 202,20; 646,70 ± 222,80) > T3 (440,00 ± 216,30; 523,80 ± 29,70) > T6 (295,60 ± 147,20; 392,60 ± 191,10) (ρ < 0,01). Em T0 e T3, esses níveis foram mais altos que os dos controles (247,35 ± 56,31; 316,30 ± 46,03) (p < 0,001), mas em T6 já eram iguais aos controles. A produção de IL-10 (pg/mL): T0 (60,3 ± 23,11; 81,05 ± 24,58) > T3 (42,57 ± 21,21; 58,81 ± 24,58) > T6 (27,52 ± 18,48; 39,86 ± 23,82) (ρ < 0,01), todos acima dos obtidos dos controles (9,40 ± 7,08; 16,80 ± 9,86) (p < 0,001).
Os níveis de TGF-β (pg/mL): T0 (636,60 ± 191,40) > T3 (492,50 ± 185,10; 676,80 ± 1 74,10) > T6 (318,30 ± 135,70; 476,10 ± 200) (ρ < 0,01). Em todos os momentos, com exceção de T6, com estímulo, os níveis de TGF-β dos doentes foram significativamente maiores que os dos controles (176,30 ± 54,73; 458,45 ± 117,03) (p < 0,001). (Tabela 2 e Figuras 1 e 2).


 Discussão
DiscussãoDiversos estudos têm demonstrado a existência de forte RFA em pacientes com TBP pela elevação na concentração plasmática da PCR e do VHS.(14,15) No presente estudo, também foram encontrados níveis iniciais de PCR, AGA e VHS acima dos ref., indicando uma possível utilização desses como marcadores auxiliares no diagnóstico presuntivo da doença, nos casos que apresentarem baciloscopia negativa e com quadro clínico-epidemiológico sugestivo de doença em atividade, tornando mais segura a indicação do teste terapêutico.
Além de marcadores de atividade da doença, os marcadores de RFA também têm sido estudados como avaliadores do efeito do tratamento específico na TBP. Há relatos que sugerem a normalização do VHS como marcador de boa resposta ao tratamento em doenças subagudas e crônicas, como a tuberculose.(16,17) Diversos autores demonstraram níveis aumentados dos marcadores de RFA, PCR, AGA e VHS na fase inicial, que vão diminuindo ao longo do tratamento.(14,15) Nos resultados deste estudo, os doentes com TBP também apresentaram níveis de PCR aumentados pré-tratamento em relação aos níveis encontrados após três e seis meses de terapia, o que sugere a utilidade desse marcador na prática clínica para avaliar a resposta ao tratamento. Autores sugeriram o uso de AGA, haptoglobina, alfa-1 antitripsina e ácido siálico como indicadores bioquímicos sensíveis de prognóstico e monitoramento da resposta ao tratamento antituberculose.(15)
Vários autores têm demonstrado a importância das citocinas como marcadores de atividade da tuberculose ou de resposta ao tratamento específico. Quando este é efetivo, há recuperação da resposta Th1, com subseqüente contenção do bacilo.(18,19)
Embora se reconheça o papel importante do IFN-γ na formação do granuloma induzido pelo M. tuberculosis, os resultados dos estudos do comportamento dessa citocina nos doentes não são homogêneos. Essas discordâncias se devem a diferenças na metodologia utilizada nos trabalhos ou aos momentos evolutivos da doença em que a citocina foi quantificada. Alguns estudos ainda têm demonstrado relação entre a produção de certas citocinas e a gravidade da doença.(20-23)
Em um estudo,(14) encontraram-se a produção de IFN-γ por PBMCs, estimulada por M. tuberculosis, abaixo do normal antes do tratamento, com aumento progressivo até níveis próximos aos dos controles no final. Diferindo desses resultados, no presente estudo, a produção de IFN-γ pelas células dos pacientes, estimuladas ou não, foi maior que a dos controles, antes e aos três meses, com diminuição progressiva até valores normais no final da terapia. No entanto, no estudo acima citado,(14) os pacientes tinham doença moderada e avançada, e o IFN-γ foi dosado em sobrenadante de PBMCs após seis dias de incubação, ao passo que, no presente estudo, os doentes tinham tuberculose de intensidade moderada, e o sobrenadante foi obtido após 24 h.
Outros autores não encontraram diferenças significativas entre os valores de IFN-γ obtidos dos pacientes, apesar de menores, com relação ao controle.(19) Entretanto, outros trabalhos demonstraram níveis elevados de IFN-γ no soro dos pacientes com tuberculose em atividade, antes da terapia.(24,25) Em outro trabalho,(24) foi demonstrado que os níveis séricos de IFN-γ estavam significativamente mais elevados nos pacientes antes da terapia, sendo os maiores níveis apresentados pelos indivíduos com febre, e que após o tratamento, esses níveis se normalizaram. Uma pequena diminuição na produção de IFN-γ ao longo do tratamento também foi demonstrada por outro estudo.(25) Pacientes com TBP apresentaram níveis, apesar de variáveis, menores aos dois meses de tratamento, em relação ao seu início.(25)
Finalmente, vários autores observaram produção elevada de IFN-γ por PBMCs, submetidas a diversos estímulos antigênicos, em pacientes tuberculosos antes do tratamento, a qual se manteve alta após o término da terapia específica.(20-22)
O TNF-α é outra citocina participante da formação do granuloma, com níveis elevados no líquido pleural, no plasma ou em cultura de monócitos de pacientes com tuberculose, antes ou após o início do tratamento, quando comparados com os pacientes crônicos ou indivíduos normais. Esses relatos sugerem que o TNF-α é necessário no início do processo inflamatório para limitar a multiplicação da micobactéria.(18,19,26) Outros estudos mostraram que os níveis iniciais elevados de TNF-α na TBP diminuíam significativamente ao longo do tratamento, ao mesmo tempo em que involuía o processo inflamatório.(14,26) No presente estudo, a produção de TNF-α pelos monócitos dos pacientes, estimulados ou não, também foi maior do que a dos controles antes do início, aos três meses e ao final do tratamento. Apesar de sempre maior que a dos normais, a produção da citocina diminuiu significativamente ao longo do tratamento, sendo os níveis finais menores que os iniciais. Esses níveis pós-tratamento mais altos do que os normais, também encontrados em outro estudo, sugerem que o TNF-α tem função protetora, além do importante papel na imunopatogenia da doença.(20)
A citocina de efeito antiinflamatório IL-10 encontra-se aumentada na tuberculose.(27) Esse efeito é útil, pois arrefece a atividade pró-inflamatória do IFN-γ e do TNF-α, e confere certa proteção contra a destruição tecidual do perfil Th1. Níveis elevados dessa citocina também são encontrados em contatos saudáveis de pacientes tuberculosos, assim como em reatores à tuberculina sem a doença.(18,27,28) Embora os níveis de IL-10 sejam maiores durante a fase de grande atividade do processo inflamatório-antes do tratamento-do que durante ou após o término da terapêutica específica, estes níveis conservam-se sempre acima dos normais, ao longo do tratamento.(24)
Em outro estudo,(20) a produção inicial elevada de IL-10 por PBMCs de pacientes com TBP não se alterou com o tratamento. No presente trabalho, a produção da IL-10 por monócitos, estimulados ou não, também estava aumentada antes, durante e após o tratamento em relação aos normais, embora tenha havido diminuição na produção desta citocina ao longo do tratamento, resultados que estão de acordo com os de outros estudos.(24,26) Já em um estudo previamente citado,(14) encontraram-se valores da citocina equivalentes aos do grupo controle ao final da terapia. Novamente, as divergências entre os resultados ligam-se provavelmente às diferenças na metodologia utilizada pelos autores, às condições clínicas dos pacientes estudados, ao tempo de evolução da doença ou de tratamento, entre outras causas.(24,28)
Os monócitos de pacientes com tuberculose em atividade produzem mais TGF-β do que os de indivíduos controles. O mesmo comportamento é verificado em contatos de tuberculosos e em pacientes tratados e curados de TBP.(23,29) A citocina está presente, em níveis elevados, também no líquido pleural.(18) O presente estudo está de acordo com os dados apresentados, pois foram encontrados níveis significativamente mais elevados nos doentes, com ou sem estímulo, antes, aos três meses de tratamento e ao final deste.
Embora os níveis finais tenham sido maiores que os dos controles, houve diminuição significativa da produção de TGF-β ao longo do tratamento desses doentes.
Outros autores não encontraram diferença entre os níveis séricos de TGF-β dos doentes e dos grupos controles.(26) Sem verificarem efeito relevante do tratamento sobre os níveis desta citocina, sugeriram que a ação do TGF-β depende da sua concentração. As diferenças encontradas no comportamento de TGF-β na tuberculose, em estudos de estimulação in vitro de células, podem ser atribuídas às técnicas de isolamento e de cultura utilizadas, que nem sempre são as mesmas.(26)
Apesar do efeito indutor das citocinas pró-inflamatórias sobre a produção de marcadores de RFA, no presente estudo, a diminuição de alguns desses marcadores ao longo da terapia não se correlacionou com a das citocinas avaliadas.(30) Isso talvez se explique pelo tamanho amostral e pela heterogeneidade da população avaliada. Novos estudos são necessários, com número maior de doentes, para que se compreenda melhor o mecanismo da relação entre a RFA e as citocinas.
Neste trabalho, os pacientes com TBP em T0 apresentavam perfil Th0, com citocina de perfil Th1 (IFN-γ) coexistindo com a de Th2 (IL-10). Nesta fase, a produção de TGF-β, citocina regulatória e indutora de fibrose, assim como de TNF-α, pró-inflamatória essencial para formação e manutenção de granuloma, também estava elevada. O equilíbrio entre atividade pró- e antiinflamatória persistiu ao longo do tratamento até T6, quando os pacientes evoluíram para o perfil Th2, com normalização dos níveis de IFN-γ, provavelmente para proteger dos efeitos da atividade pró-inflamatória do perfil Th1 e garantir a cicatrização adequada, com o desenvolvimento de fibrose.
Os níveis aumentados de globulinas, AGA, PCR e VHS nos doentes em T0, concordantes com outros estudos, sugerem sua utilidade no auxílio do diagnóstico presuntivo da tuberculose, juntamente com o histórico clínico-epidemiológico do paciente, mesmo em indivíduos com baciloscopia negativa. A PCR demonstrou ser útil como marcador do efeito da terapia e da involução inflamatória, pois seus níveis decresceram ao longo do tratamento antituberculose e se normalizaram coincidindo com o final da terapia. O IFN-γ mostrou ter a mesma utilidade, com níveis aumentados no início, decrescentes ao longo e normais ao final do tratamento antituberculose.
Referências 1. Raja A. Immunology of tuberculosis. Indian J Med Res. 2004;120(4):213-32.
2. Moreira AL, Tsenova-Berkova L, Wang J, Laochumroonvorapong P, Freeman S, Freedman VH, et al. Effect of cytokine modulation by thalidomide on the granulomatous response in murine tuberculosis. Tuberc Lung Dis. 1997;78(1):47-55.
3. Rojas M, Olivier M, Gros P, Barrera LF, García LF. TNF-alpha and IL-10 modulate the induction of apoptosis by virulent Mycobacterium tuberculosis in murine macrophages. J Immunol. 1999;162(10):6122-31.
4. Toossi Z, Ellner JJ. The role of TGF beta in the pathogenesis of human tuberculosis. Clin Immunol Immunopathol. 1998;87(2):107-14.
5. Numerof RP, Aronson FR, Mier JW. IL-2 stimulates the production of IL-1 alpha and IL-1 beta by human peripheral blood mononuclear cells. J Immunol. 1988;141(12):4250-7.
6. Pinson DM, LeClaire RD, Lorsbach RB, Parmely MJ, Russell SW. Regulation by transforming growth factor-beta 1 of expression and function of the receptor for IFN-gamma on mouse macrophages. J Immunol. 1992;149(6):2028-34.
7. Kehrl JH, Wakefield LM, Roberts AB, Jakowlew S, Alvarez-Mon M, Derynck R, et al. Production of transforming growth factor beta by human T lymphocytes and its potential role in the regulation of T cell growth. J Exp Med. 1986;163(5):1037-50.
8. Maeda H, Kuwahara H, Ichimura Y, Ohtsuki M, Kurakata S, Shiraishi A. TGF-β enhances macrophages ability to produce IL-10 in normal and tumor-bearing mice. J Immunol. 1995;155(10):4926-32.
9. Pepys MB, Hirschfield GM. C-reactive protein: a critical update. J Clin Invest. 2003;111(12):1805-12.
10. Santos VM, Cunha SF, Cunha DF. Velocidade de sedimentação das hemácias: utilidade e limitações. Rev Assoc Med Brasil. 2000;46(3):232-6.
11. Agger EM, Andersen P. A novel TB vaccine; towards a strategy based on our understanding of BCG failure. Vaccine. 2002;21(1-2):7-14.
12. Boyum A. Separation of leukocytes from blood and bone marrow. Introduction. Scand J Clin Lab Invest Suppl. 1968;97:7.
13. Morrison DF. Multivariate statistical methods. New York: McGraw-Hill; 1967.
14. Sahiratmadja E, Alisjahbana B, de Boer T, Adnan I, Maya A, Danusantoso H, et al. Dynamic changes in pro- and anti-inflammatory cytokine profiles and gamma interferon receptor signaling integrity correlate with tuberculosis disease activity and response to curative treatment. Infect Immun. 2007;75(2):820-9.
15. Suzuki K, Takashima Y, Yamada T, Akiyama J, Yagi K, Kawashima M, et al. The sequential changes of serum acute phase reactants in response to antituberculous chemotherapy [Article in Japanese]. Kekkaku. 1992;67(4):303-11.
16. Sox HC, Liang MH. The erythrocyte sedimentation rate. Guidelines for rational use. Ann Intern Med. 1986;104(4):515-23.
17. Dubost JJ, Soubrier M, Meunie MN, Sauvezie B. From sedimentation rate to inflammation profile [Article in French]. Rev Med Interne. 1994;15(11):727-33.
18. Olobo JO, Geletu M, Demissie A, Eguale T, Hiwot K, Aderaye G, et al. Circulating TNF-alpha, TGF-beta, and IL-10 in tuberculosis patients and healthy contacts. Scand J Immunol. 2001;53(1):85-91.
19. Portales-Pérez DP, Baranda L, Layseca E, Fierro NA, de la Fuente H, Rosenstein Y, et al. Comparative and prospective study of different immune parameters in healthy subjects at risk for tuberculosis and in tuberculosis patients. Clin Diagn Lab Immunol. 2002;9(2):299-307.
20. Moura EP, Toledo VP, Oliveira MH, Spíndola-de-Miranda S, Andrade HM, Guimarães TM. Pulmonary tuberculosis: evaluation of interferon-gamma levels as an immunological healing marker based on the response to the Bacillus Calmette-Guerin. Mem Inst Oswaldo Cruz. 2004;99(3):283-7.
21. Torres M, Herrera T, Villareal H, Rich EA, Sada E. Cytokine profiles for peripheral blood lymphocytes from patients with active pulmonary tuberculosis and healthy household contacts in response to the 30-kilodalton antigen of Mycobacterium tuberculosis. Infect Immun. 1998;66(1):176-80.
22. Turner J, Corrah T, Sabbally S, Whittle H, Dockrell HM. A longitudinal study of in vitro IFNgamma production and cytotoxic T cell responses of tuberculosis patients in the gambia. Tuber Lung Dis. 2000;80(3):161-9.
23. Dlugovitzky D, Bay ML, Rateni L, Fiorenza G, Vietti L, Farroni MA, et al. Influence of disease severity on nitrite and cytokine production by peripheral blood mononuclear cells (PBMC) from patients with pulmonary tuberculosis (TB). Clin Exp Immunol. 2000;122(3):343-9.
24. Verbon A, Juffermans N, Van Deventer SJ, Speelman P, Van Deutekom H, Van Der Poll T. Serum concentrations of cytokines in patients with active tuberculosis (TB) and after treatment. Clin Exp Immunol. 1999;115(1):110-3.
25. Berktas M, Guducuoglu H, Bozkurt H, Onbasi KT, Kurtoglu MG, Andic S. Change in serum concentrations of interleukin-2 and interferon-gamma during treatment of tuberculosis. J Int Med Res. 2004;32(3):324-30.
26. Deveci F, Akbulut HH, Trugut T, Muz MH. Changes in serum cytokine levels in active tuberculosis with treatment. Mediators Inflamm. 2005;2005(5):256-62.
27. Ellner JJ. Immunosuppression in tuberculosis. Infect Agents Dis. 1996;5(2):62-72.
28. Zhang M, Lin Y, Iyer DV, Gong J, Abrams JS, Barnes PF. T-cell cytokine responses in human infection with Mycobacterium tuberculosis. Infect Immun. 1995;63(8):3231-4.
29. Fiorenza G, Rateni L, Farroni MA, Bogue C, Dlugovitzky DG. TNF-a, TGF-b and NO relationship in sera from tuberculosis (TB) patients of different severity. Immunol Lett. 2005;98(1):45-8.
30. Hernández-Pando R, Arriaga AK, Panduro CA, Orozco EH, Larriv-Sahd J, Madrid-Marina V. The response of hepatic acute phase response proteins during experimental pulmonary tuberculosis. Exp Mol Pathol. 1998;65(1):25-36.
Trabalho realizado na Faculdade de Medicina de Botucatu, Universidade Estadual Paulista "Julio de Mesquita Filho" - UNESP - Botucatu (SP) Brasil.
1. Mestre em Doenças Tropicais. Faculdade de Medicina de Botucatu, Universidade Estadual Paulista "Julio de Mesquita Filho" - UNESP - Botucatu (SP) Brasil.
2. Pesquisadora do Departamento de Microbiologia e Imunologia do Instituto Lauro de Souza Lima, Bauru (SP)Brasil.
3. Professora do Programa de Pós-Graduação em Doenças Tropicais. Faculdade de Medicina de Botucatu, Universidade Estadual Paulista "Julio de Mesquita Filho" - UNESP - Botucatu (SP) Brasil.
4. Professora Adjunta do Departamento de Doenças Tropicais e Diagnóstico por Imagem da Faculdade de Medicina de Botucatu. Universidade Estadual Paulista "Julio de Mesquita Filho" - UNESP - Botucatu (SP) Brasil.
Endereço para correspondência: Eliana Peresi. Departamento de Doenças Tropicais e Diagnóstico por Imagem, Faculdade de Medicina de Botucatu,
Universidade Estadual Paulista "Julio de Mesquita Filho", Distrito de Rubião Júnior, sem número, CEP 18618-790, Botucatu, SP, Brasil.
Tel 55 14 38116372. Fax 55 14 30119898. E-mail: elianaperesi@yahoo.com.br
Apoio financeiro: Este estudo recebeu apoio financeiro da Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES).
Recebido para publicação em 15/10/2007. Aprovado, após revisão, em 27/3/2008.







